
(1)在一定条件下,在一容积可变的密闭容器中,将SO2和O2混合发生反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-92.3KJ/mol
2SO3(g) ΔH=-92.3KJ/mol
0~4min时,容器气体压强为101 KPa.反应过程中,SO2、O2、SO3的物质的量(mol)的变化如下表:
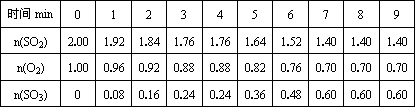
回答下列问题:
①________时,反应处于平衡状态.
②第5 min时,从速率和转化率两个方面分析,改变的外界条件是________;平衡向________方向移动.
③在0.1Mpa、500℃时,起始时O2和SO2的物质的量之比![]() 的值,与SO2平衡时的体积百分含量的变化曲线如图.
的值,与SO2平衡时的体积百分含量的变化曲线如图.
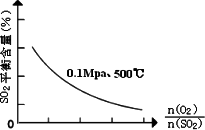
在图中画出在相同压强下,温度为400℃时,起始O2和SO2的物质的量之比![]() 的值,与SO2平衡时的体积百分含量的大致变化曲线.
的值,与SO2平衡时的体积百分含量的大致变化曲线.
(2)草酸(H2C2O4)是二元弱酸,KHC2O4溶液呈酸性.向10mL 0.01mol·L―1的H2C2O4溶液滴加0.01 mol·L―1KOH溶液V(mL),回答下列问题.
①当V<10 mL时,反应的离子方程式为________________.
②当V=10 mL时,溶液中HC2O4―、C2O42―、H2C2O4、H+的浓度从大到小的顺序为________________________.
③当V=a mL时,溶液中离子浓度有如下关系:c(K+)=2c(C2O42―)+c(HC2O4―);当V=b mL时,溶液中离子浓度有如下关系:c(K+)=c(C2O42―)+c(HC2O4―)+c(H2C2O4);则a________b(填“<”,“=”或“>”).
④当V=20 mL时,再滴入NaOH溶液,则溶液中n(K+)/n(C2O42-)的值将________(填“变大”,“变小”,“不变”),原因是________________.
科目:高中化学 来源: 题型:阅读理解
 CH3OH(g)+H2O(g);△H3
CH3OH(g)+H2O(g);△H3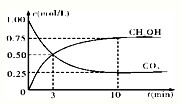
 NH3?H2O+H+
NH3?H2O+H+ NH3?H2O+H+
NH3?H2O+H+查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法:
![]() (1)在一定条件下,可逆反应(也是放热反应)N2+3H2
(1)在一定条件下,可逆反应(也是放热反应)N2+3H2![]() 2NH3能够发生,某容器内充入一定量的N2和H2,当单独改变某个条件时:
2NH3能够发生,某容器内充入一定量的N2和H2,当单独改变某个条件时:
![]() ①加催化剂,v(正)、v(逆)都发生变化,且变化倍数相等
①加催化剂,v(正)、v(逆)都发生变化,且变化倍数相等
![]() ②加压,v(正)、v(逆)都增大
②加压,v(正)、v(逆)都增大
![]() ③降温,v(正)、v(逆)都减小,且v(正)减小倍数一定大于v(逆)减小倍数
③降温,v(正)、v(逆)都减小,且v(正)减小倍数一定大于v(逆)减小倍数
![]() ④增加N2的浓度,v(正)、v(逆)都增大
④增加N2的浓度,v(正)、v(逆)都增大
![]() (2)NO和CO都是汽车尾气里的有害气体,它们能缓慢起反应生成N2和CO2.对此:
(2)NO和CO都是汽车尾气里的有害气体,它们能缓慢起反应生成N2和CO2.对此:
![]() ⑤使用催化剂不改变化学反应速率 ⑥升高温度能加快化学反应速率
⑤使用催化剂不改变化学反应速率 ⑥升高温度能加快化学反应速率
![]() ⑦降低压强能加快化学反应速率 ⑧改变压强对化学反应速率无影响
⑦降低压强能加快化学反应速率 ⑧改变压强对化学反应速率无影响
![]() (3)下列说法中:
(3)下列说法中:
![]() ⑨一定条件下增大反应物的量,会加快化学反应速率
⑨一定条件下增大反应物的量,会加快化学反应速率
![]() ⑩升高温度对放热反应会减慢反应速率,对吸热反应会加快反应速率
⑩升高温度对放热反应会减慢反应速率,对吸热反应会加快反应速率
![]() 11加大压强一定会加快反应速率
11加大压强一定会加快反应速率
![]() 12使用催化剂降低反应的活化能,所以会加快反应速率
12使用催化剂降低反应的活化能,所以会加快反应速率
![]() 正确组合是 ( )
正确组合是 ( )
![]() A.①②④⑥12 B.②③⑤⑦⑨ C.④⑤⑨⑩12 D.全部
A.①②④⑥12 B.②③⑤⑦⑨ C.④⑤⑨⑩12 D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
㈠下面的虚线框中每一列、每一行相当于周期表的每一族和每一周期,请在下面的虚线框中用实线画出周期表的上边框,并画出金属与非金属的分界线。
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
㈡.(7分)下表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素。
| A |
|
|
|
|
|
| B |
|
|
|
| D | E | F |
|
|
| C |
|
| G |
|
| H |
|
(1)在一定条件下,A与E可形成一种极易溶于水的气态化合物,其电子式为__________;实验室制取该化合物的化学方程式_________________________
(2)元素G在元素周期表中的位置____________________
(3)“神舟”六号载人飞船内需要有一种化合物来吸收航天员呼出的CO2,你认为该物质应该是由上表中的________(填字母序号)元素组成的,用化学方程式表示吸收原理:
__________________。飞船中消耗1mol该化合物转移电子的物质的量为__________
(4)飞船中需要制造一种适合航天员生存的人工态环境,还应该在氧气中充入一种稀释气体,该气体的结构式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(12分)以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
回答下列问题:
(1) 在一定条件下,SO2转化为SO3的反应为2SO2(g)+O2(g)2SO3(g),该反应的平衡常数表达式为K= ;过量的SO2与NaOH溶液反应的化学方程式为 。
![]() (2)酸溶及后续过程中均需保持盐酸过量,其目的是 、 。
(2)酸溶及后续过程中均需保持盐酸过量,其目的是 、 。
(3)通氯气氧化时,发生的主要反应的离子方程式为 ;
该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为
(写化学式)。
查看答案和解析>>
科目:高中化学 来源:2014届江西省高一下学期第一次月考化学试卷 题型:填空题
㈠下面的虚线框中每一列、每一行相当于周期表的每一族和每一周期,请在下面的虚线框中用实线画出周期表的上边框,并画出金属与非金属的分界线。
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
㈡.(7分)下表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素。
|
A |
|
|
|
|
|
|
B |
|
|
|
|
D |
E |
F |
|
|
|
C |
|
|
G |
|
|
H |
|
(1)在一定条件下,A与E可形成一种极易溶于水的气态化合物,其电子式为__________;实验室制取该化合物的化学方程式 _________________________
(2)元素G在元素周期表中的位置____________________
(3)“神舟”六号载人飞船内需要有一种化合物来吸收航天员呼出的CO2,你认为该物质应该是由上表中的________(填字母序号)元素组成的,用化学方程式表示吸收原理:
__________________。飞船中消耗1mol该化合物转移电子的物质的量为__________
(4)飞船中需要制造一种适合航天员生存的人工态环境,还应该在氧气中充入一种稀释气体,该气体的结构式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com