
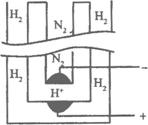
A.阳极的反应式为H2-2e-====2H+
B.阴极的反应式为 N2+6e-+6H+====2NH3
C.电解的总反应式 N2+3H2![]() 2NH3
2NH3
D.电解的总反应式 3H++N3-![]() NH3
NH3
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:阅读理解
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
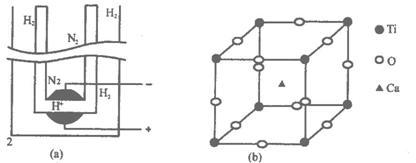
(1)写出上述电解池阴、阳两极发生的反应和电解池的总反应方程式。
阳极_______________________________________________________________;
阴极_______________________________________________________________;
总反应方程式_________________________________________________________。
(2)钙钛矿晶体中,每个钛原子周围与它最接近且等距离的钛原子共有_____个,氧、钙、钛(Ti)的原子个数比是__________。
查看答案和解析>>
科目:高中化学 来源:2013届湖北武汉部分重点学校高二下学期期末统考化学卷(解析版) 题型:填空题
(12分)现在普遍应用的工业合成氨的方法是哈伯于1905年发明的,但此法反应物的转化率不高。
(1)已知1 mol N2(g)与适量H2(g)完全反应,当生成NH3(g)0.1mol时,放出9.22kJ热量,写出反应的热化学方程式: 。
(2)若该反应在298K、398K时的化学平衡常数分别为K1、K2,则K1 K2(填“>” “=” 或 “<” )。
(3)在一定温度下,向容积不变(始终为10L)的密闭容器中加入2 mol N2、8 mol H2 及固体催化剂。10分钟后反应达到平衡状态,容器内气体压强变为起始的80%,此时氨气的体积分数为 ,用氮气表示的反应速率: 。若想提高氨气的产率,根据化学平衡移动原理,请提出合理的建议: (任意写一条)。
(4)在上述相同条件下,若起始时加入4 mol NH3、2 mol H2及固体催化剂,反应达到平衡时NH3的体积分数比(3)中 (填“大”、“小”或“相等”)。
(5)随着对合成氨研究的发展,2001年两位希腊化学家提出了电解合成氨的方法,即在常压下把氢气和用氦气稀释的氮气,分别通入一个加热到570℃的电解池中,采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨(装置如右图)。在电解法合成氨的电解池中 (填“能”或“不能”) 用水作电解质溶液的溶剂,原因是 。
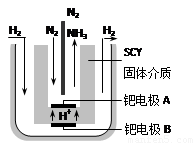
钯电极A是电解池的 极(填“阳”或“阴”),该极上的电极反应式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com