
【题目】对水样中溶质M的分解速率影响因素进行研究.在相同温度下,M的物质的量浓度(molL﹣1)随时间(min)变化的有关实验数据见表.下列说法不正确的是( )
时间 | 0 | 5 | 10 | 15 | 20 | 25 |
Ⅰ(pH=2) | 0.4 | 0.28 | 0.19 | 0.13 | 0.10 | 0.09 |
Ⅱ(pH=4) | 0.4 | 0.31 | 0.24 | 0.20 | 0.18 | 0.16 |
Ⅲ(pH=4) | 0.20 | 0.15 | 0.12 | 0.09 | 0.07 | 0.05 |
Ⅳ(pH=4,含Ca2+) | 0.20 | 0.09 | 0.05 | 0.03 | 0.01 | 0 |
A.在0~20 min内,Ⅰ中M的分解速率为0.015 molL﹣1min﹣1
B.水样酸性越强,M的分解速率越快
C.在0~20 min内,Ⅲ中M的分解百分率比Ⅱ大
D.由于Ca2+存在,Ⅳ中M的分解速率比Ⅰ快
【答案】B
【解析】解:A.在0~20 min内,Ⅰ中M的物质的量浓度变化0.3mol/L,则,Ⅰ中M的分解速率为 ![]() =0.015 molL﹣1min﹣1 , 故A正确; B.对比Ⅰ、Ⅱ组数据,0﹣5min内,Ⅰ中M的物质的量浓度变化0.12mol/L,Ⅱ中M的物质的量浓度变化0.09mol/L,则酸性增强,速率减小,故B错误;
=0.015 molL﹣1min﹣1 , 故A正确; B.对比Ⅰ、Ⅱ组数据,0﹣5min内,Ⅰ中M的物质的量浓度变化0.12mol/L,Ⅱ中M的物质的量浓度变化0.09mol/L,则酸性增强,速率减小,故B错误;
C.在0~20 min内,Ⅲ中M的浓度变化0.13mol,分解速率为 ![]() ,Ⅱ中变化0.22mol,分解速率为
,Ⅱ中变化0.22mol,分解速率为 ![]() ,则Ⅲ中M的分解百分率比Ⅱ大,故C正确;
,则Ⅲ中M的分解百分率比Ⅱ大,故C正确;
D.可对比~20 min内Ⅰ中分解速率为 ![]() 、Ⅳ中M的分解速率为
、Ⅳ中M的分解速率为 ![]() ,可知Ⅳ中M的分解速率比Ⅰ快,故D正确.
,可知Ⅳ中M的分解速率比Ⅰ快,故D正确.
故选B.
【考点精析】认真审题,首先需要了解化学平衡的计算(反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%).


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
【题目】将1.0mol I2 (g)和2.4mcl H2置于某2L密闭容器中,在某一温度下发生反应H2(g)+I2(g)2HI(g)△H<0,并达平衡,12的转化率a(I2)随时间变化如图曲线Ⅱ所示 
(1)若改变反应条件,在某条件下a(I2)的变化如曲 线(I )所示,则该条件可能是:(填序号)
①恒容条件下,升高温度
②恒温条件下,缩小反应容器体积
③恒温条件下,扩大反应容器体积
④恒温、恒容条件下,加入适当催化剂
(2)该温度下此化学反应的化学平衡常数为 .
(3)在图基础上画出恒容条件下,降低温度,I2的转化率a(I2)随时间变化的曲线 .
(4)若在原平衡的基础上,保持体系温度不变,再往体系中通入1.4mol I2(g)和0.6mol HI(g),计算再次达到平衡时I2(g)的物质的量.(写出计算过程,已知最后结果保留2位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期主族元素W,X,Y,Z的原子序数依次增大,W,X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性.下列说法正确的是( )
A.简单离子半径:W<X<Z
B.W与X形成的化合物溶于水后溶液呈碱性
C.气态氢化物的热稳定性:W<Y
D.最高价氧化物的水化物的酸性:Y>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置中,在U形管底部盛有CCl4,分别在U形管两端小心倒入饱和食盐水和稀硫酸溶液,并使a、b两处液面相平,然后分别塞上插有生铁丝的塞子,密封好,放置一段时间后,下列有关叙述中错误的是

A. 铁丝在两处的腐蚀速率:a < b
B. a、b两处相同的电极反应式为Fe-2e-==Fe2+
C. 一段时间后,a处液面高于b处液面
D. 生铁丝中的碳在a、b两处分别作原电池的负极和正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用平衡移动原理解释的是( )
A. 开启啤酒有泡沫逸出
B. 双氧水中加入二氧化锰气泡产生速率加快
C. 合成氨增压,氨产率增大
D. 装有NO2的烧瓶置于热水中颜色加深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃A不能使溴水褪色,0.5 mol A完全燃烧时,得到1.5 mol H2O和67.2 L CO2(标准状况)。
(1)通过计算确定A的结构简式为__________________。
(2)写出A与浓硝酸和浓硫酸的混合酸在水浴加热条件下反应生成C的化学方程式:_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电镀工业中往往产生大量的有毒废水,必须经过严格处理后才可以排放.某种含A离子(阴离子)废水在排放前的处理过程如下: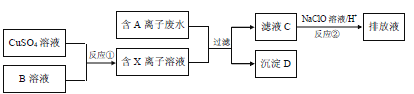
已知:9.0g沉淀D在氧气中灼烧后,产生8.0g黑色固体,生成的气体通过足量澄清石灰水时,产生10.0g白色沉淀,最后得到的混合气体除去氧气后,还剩余标况下密度为1.25gL﹣1的气体E 1.12L.
(1)E的结构式
(2)沉淀D的化学式
(3)写出沉淀D在氧气中灼烧发生的化学方程式
(4)滤液C中还含有微量的A离子,通过反应②,可将其转化为对环境无害的物质,试用离子方程式表示该原理
(5)反应①为制得某种元素的低价X离子,试从氧化还原反应的角度分析,是否可以用Na2SO3溶液来代替B溶液,说明理由 ,并设计实验方案证明Na2SO3溶液是否变质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com