
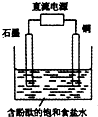
| A. | 铜电极上发生还原反应 | B. | 石墨电极附近溶液呈红色 | ||
| C. | 溶液中的Na+向石墨电极移动 | D. | 铜电极附近观察到黄绿色气体 |
分析 根据电解饱和食盐水的装置,如果通电后两极均有气泡产生,则金属铜电极一定是阴极,根据电解池的工作原理结合电极反应来回答判断即可.
解答 解:根据电解饱和食盐水的装置,如果通电后两极均有气泡产生,则金属铜电极一定是阴极,该极上的反应:2H++2e-=H2↑,阳极上是氯离子失电子,发生的电极反应为:2Cl--2e-=Cl2↑.
A、金属铜电极是阴极,该极上的反应为2H++2e-=H2↑,属于还原反应,故A正确;
B、石墨电极是阳极,该电极附近发生的电极反应为:2Cl--2e-=Cl2↑,可以观察到黄绿色气体产生,而不是氢离子放电所以石墨电极附近溶液不呈红色,故B错误;
C、电解池中,阳离子移向阴极,即移向铜电极,故C错误;
D、金属铜电极一定是阴极,该极上的反应为2H++2e-=H2↑,铜电极附近观察到无色气体,故D错误.
故选A.
点评 本题考查学生电解池的工作原理知识,注意电解池的阳极材料决定电极反应的书写,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | Na2CO3比NaHCO3易溶于水 | |
| B. | Na2CO3比NaHCO3稳定 | |
| C. | Na2CO3溶液比NaHCO3溶液碱性强 | |
| D. | 碳酸钠与盐酸反应放出二氧化碳的剧烈程度强于碳酸氢钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
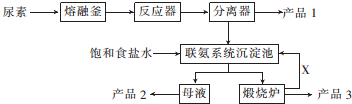
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
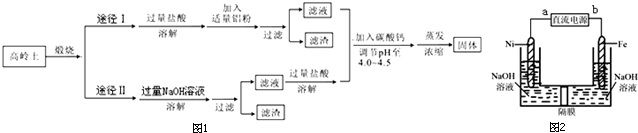
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中国古代利用明矾的溶液的酸性清除铜镜表面的铜锈 | |
| B. | SO2可以用来漂白纸浆、毛、丝、草帽辫、增白食品等 | |
| C. | 14C可用于文物年代的鉴定,14C与12C互为同位素 | |
| D. | 喝补铁剂时,加服维生素C效果更好,原因是维生素C具有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO(NH2)2 | B. | (NH4)2CO3 | C. | NH4NO3 | D. | CH3COONH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
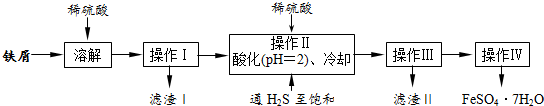
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 保存在水中 | B. | 密封,保存在广口瓶中 | ||
| C. | 用铝箔包裹,密封在广口瓶中 | D. | 密封,保存在煤油中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com