
【题目】在下列离子方程式中,不能用离子反应方程式 SO42-+Ba2+=BaSO4↓来表示的
A. Ba(NO3)2+H2SO4=BaSO4↓+2HNO3 B. BaCl2 + Na 2SO4=BaSO4↓+ 2NaCl
C. Ba(OH)2+H2SO4=BaSO4↓+2H2O D. BaCl2 +H2SO4=BaSO4↓+2HCl
 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案科目:高中化学 来源: 题型:
【题目】金属元素在自然界中分布很广,其中铜等在生产生活中有着广泛的应用.
(1)科学家通过X射线推测胆矾结构示意图如图1所示,①写出基态Cu原子的核外电子排布式;金属铜采用下列(填字母代号)堆积方式
②胆矾中含有的微粒间作用力有(填字母代号).
a.离子键 b.极性键 c.金属键 d.配位键 e.氢键 f.非极性键
③铜离子形成胆矾中配离子的离子方程式为:;
(2)合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前常用醋酸二氨合铜(I)溶液来吸收原料气体中的CO(Ac﹣表示CH3COO﹣),其反应是:[Cu(NH3)2]Ac+CO+NH3[Cu(NH3)3]Ac.CO[醋酸碳基三氨合铜(Ⅰ)]△H<0①C、N、O三种元素的第一电离能由小到大的顺序为
②氨分子中N原子的杂化方式为
(3)铜的化合物种类也很多,其常见价台为+1,+2价.如CuO、Cu2O、CuH等,如图2是同的一种氯化铜的晶胞结构,则它的化学式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.利用石蜡油在碎瓷片上分解可得纯净的乙烯
B.甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应
C.苯可使溴水褪色,是发生了取代反应
D.C4H9Cl有4种同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对有关实验事实的说明或解释正确的是( )
A.浓硫酸和浓盐酸长期暴露在空气中浓度都会降低,但原理不相同
B.常温下,浓硫酸可以用铁制容器储存,说明铁与冷的浓硫酸不反应
C.向某溶液中加入盐酸酸化的氯化钡溶液,生成白色沉淀,说明原溶液中一定含有SO ![]()
D.向某溶液中滴加氯水后,再加入KSCN溶液,溶液呈红色,说明原溶液中一定含有Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用系统命名法命名或写出结构简式:
(1)3-甲基-2-丙基-1-戊烯的结构简式为______________________________
(2)![]() 名称为_______________________________________
名称为_______________________________________
(3)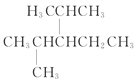 名称为:________________________________
名称为:________________________________
(4)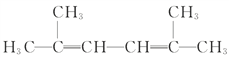 名称为:_______________
名称为:_______________
(5)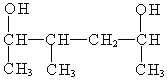 名称为:___________________________
名称为:___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示各物质之间的转化关系.已知D、E、Z是中学化学常见的单质,其他都是化合物.Z、Y是氯碱工业的产品.D元素的原子最外层电子数与电子层数相等,且D的硫酸盐可作净水剂.E为日常生活中应用最广泛的金属.除反应①外,其他反应均在水溶液中进行.请回答下列问题.
(1)写出X的电子式: .
(2)常温时pH=12的G溶液中,溶质的阳离子与溶质的阴离子浓度之差为(写出计算式).
(3)在电镀工业中,若将E作为待镀金属,铜为镀层金属,则铜是极,请写出在E电极上发生的电极反应式: .
(4)写出反应③的离子方程式: .
(5)现有无标签的Y和M的两种无色水溶液,不用其他任何试剂,请你设计一个简单的实验对这两种溶液加以鉴别(回答实验操作、现象及结论).
(6)A溶液与NaOH溶液混合可形成沉淀,某温度下此沉淀的Ksp=2.097×l0﹣39 . 将0.01mol/L的A溶液与0.001molL﹣1的NaOH溶液等体积混合,你认为能否形成沉淀(填“能”或“不能”),请通过计算说明 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,下列溶液的离子浓度关系式正确的是( )
A. pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5mol·L-1
B. pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C. pH=2的乙二酸(H2C2O4)溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)
D. pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种清洁能源,又是合成氨工业的重要原料.
(1)已知:CH4(g)+H2O(g)═CO(g)+3H2(g)△H=206.2kJmol﹣1CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=247.4kJmol﹣1
甲烷和H2O(g)反应生成H2和CO2的热化学方程式为 .
(2)工业合成氨的反应原理为N2(g)+3H2(g)═2NH3(g)△H=﹣92.4kJmol﹣1 . 某温度下,把10mol N2与28mol H2置于容积为10L的密闭容器内,10min时反应达到平衡状态,测得氮气的平衡转化率为60%,则10min内该反应的平均速率v(H2)=molL﹣1min﹣1 , 则该温度下该反应的平衡常数K= . 欲增大氮气的平衡转化率,可采取的措施有(写一种措施即可).
(3)如图所示装置工作时均与H2有关. 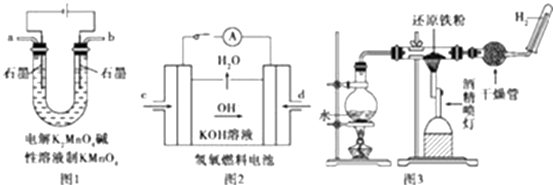
①图1所示装置中阳极的电极反应式为
②图2所示装置中,通入H2的管口是(选填字母代号).
③某同学按图3所示装置进行实验,实验结束后,将玻璃管内固体物质冷却后,溶于稀硫酸,充分反应后,滴加KSCN溶液,溶液不变红,再滴入新制氯水,溶液变为红色.该同学据此得出结论:铁与水蒸气反应生成FeO和H2 . 该结论(填“严密”或“不严密”),你的理由是(用离子方程式和必要的文字说明).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】柠檬烯是一种食用香料,其结构简式为: ![]() 有关柠檬烯的分析正确的是( )
有关柠檬烯的分析正确的是( )
A.分子式为C10H14
B.一定条件下,柠檬烯可以发生加成、取代、氧化、还原反应
C.柠檬烯有属于苯的同系物的同分异构体
D.柠檬烯的分子中所有碳原子可能处在同一个平面上
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com