
| A. |  用装置制取氯气 | |
| B. | 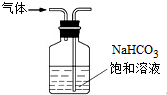 用装置除去氯气中混有的少量氯化氢 | |
| C. | 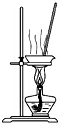 用装置蒸干氯化锰溶液制MnCl2•4H2O | |
| D. | 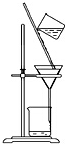 用装置分离二氧化锰和氯化锰溶液 |
分析 A.二氧化锰和浓盐酸制备氯气需要加热;
B.二者均与碳酸氢钠溶液反应;
C.锰离子水解,水解吸热;
D.只有二氧化锰不溶于水.
解答 解:A.二氧化锰和浓盐酸制备氯气需要加热,甲装置无加热仪器,故A错误;
B.饱和碳酸氢钠溶液呈碱性,能吸收氯气,且NaHCO3和HCl反应能生成CO2,引入新的杂质气体,所以吸收试剂应该为饱和食盐水,并且气体应为长进短出,故B错误;
C.锰离子水解,水解吸热,因此不能直接加热蒸发氯化锰溶液制MnCl2•4H2O,应该在HCl的气氛中进行,故C错误;
D.二氧化锰不溶于水,因此分离二氧化锰和氯化锰溶液需要过滤,丙装置为过滤装置,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高考常见题型,涉及物质制备实验、混合物分离提纯实验,把握实验装置的作用及实验技能为解答的关键,侧重分析与实验能力的考查,题目难度不大.


 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:选择题
| A. | 可用澄清石灰水鉴别Na2CO3和NaHCO3溶液 | |
| B. | 浓硫酸具有吸水性,可做干燥剂,但不能干燥NH3 | |
| C. | 钠保存在煤油中,若长期放置在空气中,最终变为NaHCO3 | |
| D. | 镁着火后可以用CO2来灭火 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
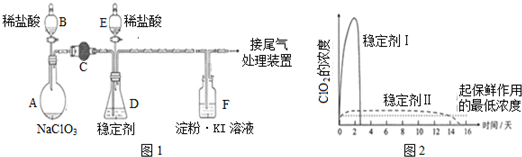
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
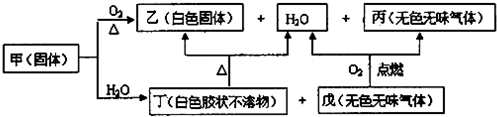
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丁达尔现象可以用来区别胶体和溶液 | |
| B. | 水银、水玻璃、胆矾都是纯净物 | |
| C. | HCl、NH3、BaSO4都是电解质 | |
| D. | H2、D2、T2属于同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验操作 | 预期现象与结论 |
| 步骤1: | 有白色沉淀生成,证明待测液中含SO42- |
| 步骤2: | 溶液呈橙黄色,证明待测液中含Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 黑火药由硫磺、硝石、木炭三种物质按一定比例混合制成 | |
| B. | 炸油条时,常将小苏打和明矾混用做发酵剂 | |
| C. | 大力推广应用燃料“脱硫、脱硝”技术,可减少硫氧化物和氮氧化物对空气的污染 | |
| D. | PM2.5颗粒在大气中可形成气溶胶,具有丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
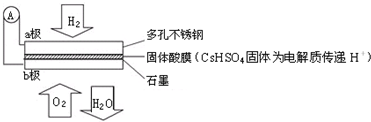
| A. | 电子通过外电路从a极流向b极 | |
| B. | H+由a极通过固体酸电解质传递到b极 | |
| C. | 电池工作时每转移0.1 mol电子,消耗1.12 LH2 | |
| D. | b极上的电极反应式为:O2+4H++4e-=2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com