
| A元素的核外电子数和电子层数相等 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能如下: I1=738kJ•mol-1 I2=1451kJ•mol-1 I3=7733kJ•mol-1 I4=10540kJ•mol-1 |
| D原子核外所有p轨道全满或不满 |
| E元素的主族序数于周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
 .
.
分析 A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大,A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素,A为H元素;
B元素原子的核外p电子数比s电子数少1,B有2个电子层,为1s22s22p3,故B为N元素;由C原子的第一至第四电离能数据可知,第三电离能剧增,故C表现+2价,处于ⅡA族,原子序数大于N元素,故C为Mg元素;D处于第三周期,D原子核外所有p轨道全满或半满,最外层排布为3s23p3,故D为P元素;E处于第三周期,E元素的主族序数与周期数的差为4,E处于第ⅦA族,故E为Cl元素;F是前四周期中电负性最小的元素,F为第四周期元素,故F为K元素,G在第四周期周期表的第7列,G为Mn元素,由此分析解答.
解答 解:A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大,A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素,A为H元素;
B元素原子的核外p电子数比s电子数少1,B有2个电子层,为1s22s22p3,故B为N元素;由C原子的第一至第四电离能数据可知,第三电离能剧增,故C表现+2价,处于ⅡA族,原子序数大于N元素,故C为Mg元素;D处于第三周期,D原子核外所有p轨道全满或半满,最外层排布为3s23p3,故D为P元素;E处于第三周期,E元素的主族序数与周期数的差为4,E处于第ⅦA族,故E为Cl元素;F是前四周期中电负性最小的元素,F为第四周期元素,故F为K元素,G在第四周期周期表的第7列,G为Mn元素,(1)NH5为离子化合物,是由NH4+与H-两种粒构成,电子式为 ,故答案为:
,故答案为: ;
;
(2)B为N元素,核外电子排布式为1s2ns2np3,基态原子中能量最高的电子,处于2p能级,有3个电子,其电子云在空间有3个方向,原子轨道呈纺锤形,
故答案为:3;纺锤;
(3)某同学根据上述信息,推断C基态原子的核外电子排布为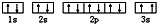 ,该同学所画的电子排布图中3s能级,2个电子自旋方向相同,违背了泡利原理,故答案为:泡利原理;
,该同学所画的电子排布图中3s能级,2个电子自旋方向相同,违背了泡利原理,故答案为:泡利原理;
(4)G为Mn元素,是25号元素,位于第四周期第ⅦB族,最后填充的为d电子,为d区元素,价电子排布式为3d54s2,
故答案为:ⅦB;d;3d54s2;
(5)PCl3中心原子P原子成3个σ键,P原子价层电子对是为3+1=4,含有1对孤对电子对,杂化轨道数为4,杂化方式为sp3,其空间构型为三角锥,
故答案为:sp3;三角锥;
(6)F为K元素,检验F元素的方法是焰色反应,产生此现象的原因是当基态原子的电子吸收能量后,电子会跃迁到较高能级,变成激发态原子.电子从较高能量的激发态跃迁到较低能量的激发态或基态时,将以光的形式释放能量,故答案为:焰色反应;当基态原子的电子吸收能量后,电子会跃迁到较高能级,变成激发态原子.电子从较高能量的激发态跃迁到较低能量的激发态或基态时,将以光的形式释放能量.
点评 本题考查结构性质与位置关系、核外电子排布规律、电子式、杂化轨道理论、元素周期表等,综合性较大,难度中等,推断元素是解题的关键,注意基础知识的掌握.


科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸保存在无色玻璃试剂瓶中 | |
| B. | 氢氧化钠溶液保存在橡皮塞的玻璃试剂瓶中 | |
| C. | 漂白粉应密封保存 | |
| D. | 新制的氯水通常保存在棕色玻璃试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①和② | B. | 只有② | C. | ②③④ | D. | 只有④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在Na2A、NaHA两溶液中,离子种类不相同 | |
| B. | 在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-) | |
| C. | 在溶质物质的量相等的Na2A、NaHA两溶液中,阴离子总数相等 | |
| D. | 在Na2A溶液中一定有:c(Na+)>c(A2-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 石墨比金刚石稳定 | |
| B. | 金刚石比石墨稳定 | |
| C. | 1mol石墨比1 mol金刚石的总能量高 | |
| D. | 1mol石墨比1 mol金刚石的总能量低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴定终点时俯视读数 | |
| B. | 滴定前滴定管尖嘴中有一气泡,滴定后气泡消失了 | |
| C. | 锥形瓶未用待测液润洗 | |
| D. | 滴定前,滴定管中的溶液液面最低点未定在“0”点 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 ,含钠元素的物质焰色反应时呈黄色.
,含钠元素的物质焰色反应时呈黄色.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com