
| 草酸 | 碳酸 | |
| 一级电离常数(Kad) | 5.9×10-2 | 4.2×10-7 |
| 二级电离常数(Kad) | 6.4×10-3 | 5.6×10-11 |
分析 (1)草酸的分子式是H2C2O2,根据氢为+1价,氧为-2价,结合化合价代数和为为0,其中碳元素的化合价为+3,草酸官能团的名称是羧基;
(2)少量碳酸钠固体所以草酸过量,而根据草酸的电离度,草酸的酸性远大于碳酸的酸性,所以草酸一级电离产生的氢离子就可以将碳酸钠完全反应;
(3)CaC2O4的沉淀溶解平衡为:CaC2O4(s)?Ca2+(aq)+C2O42-(aq),难溶物溶度积等于电离产生离子的浓度幂之积,据此写出该温度下溶度积的表达式Ksp(CaC2O4);根据平衡移动的原理分析解答;
(4)将0.2mol/L的NaOH溶液缓缓地滴入10mL0.1mol/L的草酸溶液中,当滴入NaOH溶液的体积为7.5mL时,得到草酸钠和草酸氢钠的混合溶液,溶液呈酸性,所以以草酸氢根离子的大于草酸根离子的水解;当滴入NaOH溶液的体积为10mL时,得到草酸钠,所以根据物料,2c(HC2O4-)+2c(C2O42-)=c(Na+),由此分析解答;
(5)①为了配制准确浓度的草酸溶液,所需要的实验仪器主要有天平(含砝码)、烧杯、药匙、100mL容量瓶、胶头滴管、玻璃棒等;
②发生反应:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O,根据方程式计算样品中草酸的质量,进而计算草酸的质量分数.
解答 解:(1)草酸的分子式是H2C2O2,根据氢为+1价,氧为-2价,结合化合价代数和为为0,其中碳元素的化合价为+3,草酸官能团的名称是羧基,故答案为:+3;羧基;
(2)少量碳酸钠固体所以草酸过量,而根据草酸的电离度,草酸的酸性远大于碳酸的酸性,所以草酸一级电离产生的氢离子就可以将碳酸钠完全反应,所以反应的方程式为:2H2C2O4+Na2CO3=2NaHC2O4+CO2↑+H2O,故答案为:2H2C2O4+Na2CO3=2NaHC2O4+CO2↑+H2O;
(3)CaC2O4的沉淀溶解平衡为:CaCrO4(s)?Ca2+(aq)+CrO42-(aq),难溶物溶度积等于电离产生离子的浓度幂之积,据此写出该温度下溶度积的表达式KspCaC2O4)=c(Ca2+).c(C2O42-),草酸钙在人体体液中存在溶解平衡,即CaCrO4(s)?Ca2+(aq)+CrO42-(aq),乙二胺四乙酸(EDTA)结合Ca2+生成可溶性物质,平衡正向移动,结石逐渐溶解,故答案为:c(Ca2+).c(C2O42-);草酸钙在人体体液中存在溶解平衡,即CaCrO4(s)?Ca2+(aq)+CrO42-(aq),乙二胺四乙酸(EDTA)结合Ca2+生成可溶性物质,平衡正向移动,结石逐渐溶解;
(4)将0.2mol/L的NaOH溶液缓缓地滴入10mL0.1mol/L的草酸溶液中,当滴入NaOH溶液的体积为7.5mL时,得到草酸钠和草酸氢钠的混合溶液,溶液呈酸性,所以以草酸氢根离子的大于草酸根离子的水解;当滴入NaOH溶液的体积为10mL时,得到草酸钠,所以根据物料,2c(HC2O4-)+2c(C2O42-)=c(Na+),所以c(HC2O4-)+2c(C2O42-)<c(Na+),故答案为:大于;<;
(5)①为了配制准确浓度的草酸溶液,所需要的实验仪器主要有天平(含砝码)、烧杯、药匙、100mL容量瓶、胶头滴管、玻璃棒等,故答案为:100 mL容量瓶、胶头滴管;
②在测定过程中,高锰酸钾为氧化剂,草酸为还原剂,反应的离子方程式为:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O,根据方程式可得关系式:
5H2C2O4•2H2O~2KMnO4
5 2
n 0.02mol/L×14.8×10-3L×$\frac{100mL}{20mL}$
解得:n(H2C2O4•2H2O)=3.7×10-3mol
则m(H2C2O4•2H2O)=3.7×10-3mol×126g/mol=0.4662g,
所以成品的纯度为:$\frac{0.4662g}{0.500g}$×100%=93.2%,
故答案为:93.2%.
点评 本题考查实验制备方案的设计、物质分离与提纯方法的综合应用,题目难度中等,涉及化学实验基本操作、工艺流程、氧化还原反应滴定计算、物质含量的测定等知识,根据题中已知条件确定生成物并写出反应方程式明确原理是解题关键,是对学生综合能力的考查.


科目:高中化学 来源: 题型:选择题
| A. | 碱性溶液:Cu2+、Al3+、NO3-、SO42- | |
| B. | 加入KSCN显红色的溶液:K+、NH4+、Cl-、I- | |
| C. | 加入Al能放出大量H2的溶液中:NH4+、Fe2+、NO3-、SO42- | |
| D. | 常温下,c(H+)/c(OH一)=1×10-12的溶液:K+、AlO2-、CO32-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
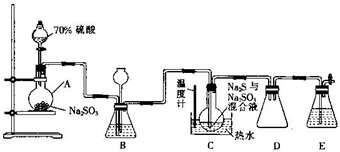 Na2S2O3•5H2O俗称:“海波”,是常用的定影剂和还原剂,它是无色晶体,易溶于水,不溶于乙醇,遇酸易分解:S2O32-+2H+=S↓+SO2↑+H2O,在20℃和70℃时的溶解度分别为60.0g和212.0g,Na2S2O3•5H2O在40~50℃时会熔化,48℃时会分解,工业上常利用含硫废水生产Na2S2O3•5H2O,实验室可用如图所示的装置(略去部分夹持仪器)模拟生成过程.
Na2S2O3•5H2O俗称:“海波”,是常用的定影剂和还原剂,它是无色晶体,易溶于水,不溶于乙醇,遇酸易分解:S2O32-+2H+=S↓+SO2↑+H2O,在20℃和70℃时的溶解度分别为60.0g和212.0g,Na2S2O3•5H2O在40~50℃时会熔化,48℃时会分解,工业上常利用含硫废水生产Na2S2O3•5H2O,实验室可用如图所示的装置(略去部分夹持仪器)模拟生成过程.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
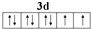 ,写出A、B形成化合物的电子式
,写出A、B形成化合物的电子式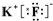
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
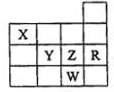
| A. | 常压下五种元素的单质中W单质的沸点最高 | |
| B. | Y、Z和W的阴离子半径依次增大 | |
| C. | X的氢化物比同族元素的氢化物还原性强 | |
| D. | Z元素的最高价氧化物的水化物酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H、D、T互为同分异构体 | B. | 次氯酸的结构式为 H-Cl-O | ||
| C. | NH4Cl的电子式 为: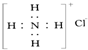 | D. | S2-的结构示意图为: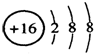 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BF3是三角锥形分子 | |
| B. | NH4+的电子式: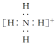 ,离子呈平面形结构 ,离子呈平面形结构 | |
| C. | CO2的分子模型示意图: | |
| D. | CH4分子中的碳原子以4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成4个s-sp3σ键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
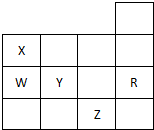
| A. | 常温时五种元素的单质中,Z单质的沸点最高 | |
| B. | Y元素的非金属性比W元素的非金属性强 | |
| C. | Y、Z的阴离子的电子层结构都与R原子的相同 | |
| D. | Y的氢化物的沸点比H2O的沸点高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com