
【题目】下列分离方法中不正确的是( )
A.利用萃取方法用四氯化碳提取溴水中的溴单质
B.利用蒸馏的方法可以分离沸点相差较大的液体混合物
C.利用分液的方法分离酒精和水
D.利用结晶的方法除去KNO3中的氯化钾
科目:高中化学 来源: 题型:
【题目】常温下,0.1molL﹣1CH3COONa溶液pH=11,下列表述正确的是( )
A.c(Na+)=c(CH3COO﹣)
B.c(CH3COO﹣)+c(CH3COOH)=0.1 molL﹣1
C.由水电离出来的c(OH﹣)=1.0×10﹣11 molL﹣1
D.往该溶液中加入0.05 molL﹣1的CH3COONa,pH值变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一恒定体积的密闭容器中,进行如下化学反应:CO(g)+H2O(g)CO2(g)+H2(g),其化学平衡常数K和温度t的关系如表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= , 该反应为反应(填吸热或放热). 若增大压强,则平衡常数(填序号). A.一定不变 B.一定减小 C.一定增大 D.增大、减小、不变皆有可能
(2)能判断该反应是否达到化学平衡状态的依据是 .
A.容器中压强不变
B.混合气体中c(CO)不变
C.v逆(H2)=v正(H2O)
D.c(CO)=c(CO2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为长式周期表的一部分,其中的编号代表对应的元素. 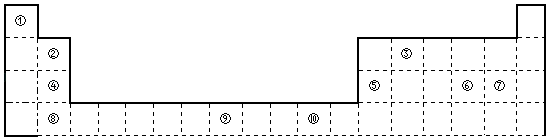
请回答下列问题:
(1)③和①形成的一种5核10电子分子,其立体构型为 , 中心原子杂化方式为 , 属于分子(填“极性”或“非极性”).
(2)元素③和⑦的最高价氧化物对应水化物中酸性较强的是:(填化学式)元素⑥的电负性元素⑦(选填“>”、“=”、“<”=)的电负性.
(3)根据元素周期表分区,元素⑨位于区,其基态原子电子排布式为 .
(4)某些不同族元素的性质也有一定的相似性,如上表中元素②与元素⑤的氢氧化物有相似的性质.请写出元素②的氢氧化物与NaOH溶液反应的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列按电解质、非电解质、酸性氧化物、碱性氧化物的组合,正确的是( )
选项 | 电解质 | 非电解质 | 酸性氧化物 | 碱性氧化物 |
A | HCl | 液氨 | CO | K2O |
B | 氯化钠溶液 | 蔗糖 | SiO2 | CaO |
C | 熔融NaCl | 氨水 | SO2 | Al2O3 |
D | CaSO4 | 酒精 | CO2 | Na2O |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,向20mL0.01mol/LCH3COOH溶液中逐滴加入0.01mol/LKOH溶液,其pH变化曲线如图所示。下列叙述错误的是

A. a>2
B. 醋酸的电离平衡常数:Ka= ![]()
C. b点溶液中:c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-)
D. a、b、c、d四点溶液的导电性强弱顺序:d>c>b>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学-选修3:物质结构与性质]镁与铝、锰形成的合金广泛应用于航天、运输、化工等领域。回答下列问题:
(1)基态Mn2+核外电子排布式为_________________。
(2)下列各项比较中,Mg>Al的是____________(填选项序号)。
A.电负性 B.金属键的强弱 C.金属性 D.基态原子第一电离能
(3)叶绿素是以镁离子为中心的卟啉配合物,其结构如图。

①Mg2+与N原子形成的化学键为配位键的是__________(填“a”或“b”)。
②叶绿素分子中C原子的杂化轨道类型有______________。
(4)MgO具有NaCl型结构(如图),MgO晶体的熔点比NaCl高的原因是________________;其中阴离子采用面心立方最密堆积方式,阴离子的配位数为___________,r(O2-)=0.148mm,MgO的密度为___________g/cm3(NA表示阿伏加德罗常数的值,列出计算式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PH3 是一种无色剧毒气体.下列判断错误的是( )
A.PH3 分子是非极性分子
B.PH3分子中有一对电子孤对
C.PH3 分子VSEPR模型的名称是四面体
D.PH3 分子稳定性低于 NH3 分子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com