
 50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:

科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
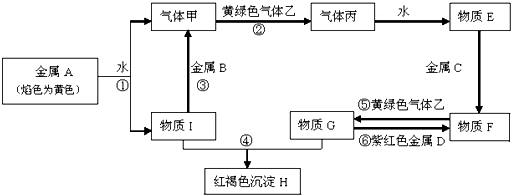
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验目的 | 玻璃仪器 | |
| A | 分离硝酸钾和氯化钠混合物 | 烧杯、酒精灯、玻璃棒、分液漏斗 |
| B | 配制450mL 2mol?L-1氯化钠溶液 | 500mL容量瓶、烧杯、玻璃棒、量筒 |
| C | 用软锰矿与浓盐酸制取并收集干燥的氯气 | 烧瓶、酒精灯、导管 |
| D | 探究镁、铝金属的活泼性顺序 | 胶头滴管、温度计、玻璃棒 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、平衡向逆反应方向移动 |
| B、平衡不移动 |
| C、溶液由浅绿色变成黄色 |
| D、溶液由浅绿色变为深绿色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com