
| A. | ①②③④ | B. | ①②⑦ | C. | ⑤⑥⑦ | D. | ③④⑤⑥ |
分析 酯化反应、消去反应一般是脱HX或H2O,会消除羟基;而-CHO可加氢(既是加成反应又是还原反应)生成-CH2OH,酯的水解可生成醇-OH,卤代烃水解可以生成醇,水解反应属于取代反应,-CHO氧化生成-COOH也可引入-OH,以此解答该题.
解答 解:①取代反应可以引入羟基,如卤代烃水解,故正确;
②加成反应可以引入羟基,如烯烃与水的加成反应,故正确;
③消去反应不可以引入羟基,可以消除羟基,故错误;
④酯化反应不能引入羟基,可以消除羟基,故错误;
⑤加聚反应中碳碳双键或三键转化为饱和键,则不能引入羟基,故错误;
⑥缩聚反应中-OH、-COOH发生酯化反应,不能不能引入羟基,故错误;
⑦还原反应可以引入羟基,如醛、酮与氢气的加成反应,故正确.
所以①②⑦正确,
故选B.
点评 本题考查有机物合成知识,为高频考点,侧重合成反应中羟基的引入的考查,题目难度不大,注意把握官能团的性质和转化即可解答该题.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 乙醇与金属钠反应时,是乙醇分子中羟基中的O-H键断裂 | |
| B. | 检验乙醇中是否含有水,可加入少量无水硫酸铜,若变蓝则含水 | |
| C. | 向待测液中加入饱和碳酸钠溶液鉴别乙酸、乙酸乙酯、乙醇 | |
| D. | 向苯和苯酚混合溶液中滴加过量浓溴水除去混合溶液中的苯酚 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝粉与氧化镁共热可制取金属镁 | |
| B. | 铝分别与足量的 HCl溶液、足量的NaOH的溶液反应,产生的氢气前者多 | |
| C. | 可用Na2SiO3溶液和CO2反应来制备H2SiO3 | |
| D. | NaOH溶液可以盛装在带玻璃塞的磨口试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ①④⑤ | C. | ①③④⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
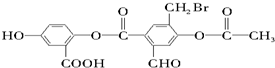 下列说法正确的是( )
下列说法正确的是( )| A. | 1 mol M最多能与10×22.4 L氢气(标准状况)发生加成反应 | |
| B. | 1 mol M最多能与2 mol Na HCO3反应 | |
| C. | 1 mol M最多能与5 mol NaOH反应 | |
| D. | 1 mol M最多能与2 mol Na反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2的消耗量是3.0mol | |
| B. | N2的平均速率是0.5mol•(L•min)-1 | |
| C. | N2的平衡浓度是1.0mol•L-1 | |
| D. | N2反应的量占原物质的量的百分数是50% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
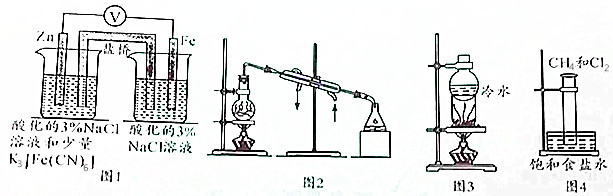
| A. | 用图1所示装置验证牺牲阳极的阴极保护法 | |
| B. | 用图2所示装置可在实验室制备蒸馏水 | |
| C. | 用图3所示装置可以进行NaCl与NH4Cl、NaCl与I2的分离 | |
| D. | 用图4所示装置进行CH4取代反应的实验 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
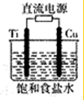 铜是人类最早利用的金属之一,铜能形成多种重要的化合物.
铜是人类最早利用的金属之一,铜能形成多种重要的化合物.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com