
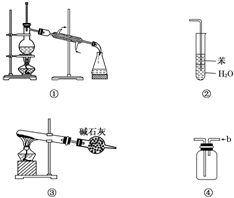
| A. | 装置①常用于分离互不相溶的液体混合物 | |
| B. | 装置②可用于吸收HCl气体,并防止倒吸 | |
| C. | 以NH4HCO3为原料,装置③可用于实验室制备少量NH3 | |
| D. | 装置④b口进气可收集H2、NO等气体 |
分析 A.分离互不相溶的液体用分液的方法;
B.HCl直接通入水中,不能防止倒吸;
C.碳酸氢铵不稳定,解热分解生成氨气、二氧化碳和水,二氧化碳、水被碱石灰吸收;
D.NO不能用排空气法收集.
解答 解:A.蒸馏用于分离沸点不同的液体,分离互不相溶的液体用分液的方法,故A错误;
B.HCl直接通入水中,不能防止倒吸,应用四氯化碳,故B错误;
C.碳酸氢铵不稳定,解热分解生成氨气、二氧化碳和水,二氧化碳、水被碱石灰吸收,可用于制备少量氨气,故C正确;
D.NO易于氧气反应,不能用排空气法收集,故D错误.
故选C.
点评 本题考查较为综合,涉及物质的分离、提纯、制备等知识,为高考常见题型,侧重于学生的分析、实验能力的考查,注意把握物质的性质以及实验的严密性和可行性的评价,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
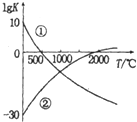 氮气是制备含氮化合物的一种重要物质,而含氮化合物的用途广泛,如图表示两个常见固氮反应的平衡常数对数值(IgK)与温度的关系:
氮气是制备含氮化合物的一种重要物质,而含氮化合物的用途广泛,如图表示两个常见固氮反应的平衡常数对数值(IgK)与温度的关系:| A. | 反应①和②均为放热反应 | |
| B. | 升高温度,反应①的反应速率减小 | |
| C. | 在常温下,利用反应①固氮和利用反应②固氮反应程度相差很大 | |
| D. | 在1000℃时,反应①和反应②体系中N2的浓度一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 pH为9的NaHB溶液中:c(HB-)>c(B2-)>c(H2B) | |
| B. | 将标准状况下的2.24LCO2通入150mL 1mol•L-1 NaOH溶液中,所得溶液中c(CO32-)>c(HCO3-) | |
| C. | 0.1mol•L-1的醋酸pH=a,0.01mol•L-1的醋酸pH=b,则a+1>b | |
| D. | 常温时①pH=12的氨水②pH=12的NaOH溶液,将两溶液稀释相同倍数后溶液的pH:②>① |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
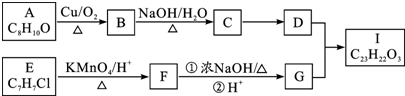
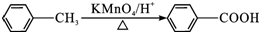
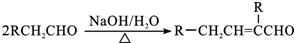
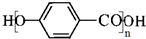
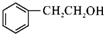 ,C→D的反应类型为加成反应,F中不含氧的官能团的名称为氯原子,I的结构简式为
,C→D的反应类型为加成反应,F中不含氧的官能团的名称为氯原子,I的结构简式为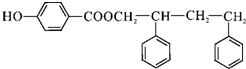 .
. ,F→G①的化学方程式为
,F→G①的化学方程式为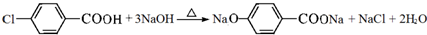 .
. .
.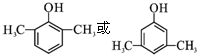 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中:K+、Na+、MnO4-、SO42- | |
| B. | 碱性溶液中:Na+、S2-、SO32-、AlO2- | |
| C. | 酸性溶液中:Na+、Fe2+、SO42-、NO3- | |
| D. | 加入Al能放出H2的溶液中:Cl-、SO42-、NO3-、Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| C. | 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ | |
| D. | 某溶液中加入硝酸银溶液,产生白色沉淀,该溶液中一定含有Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18gH218O与D2O的混合物中所含中子数为9NA | |
| B. | 60g HCHO和CH3COOH的混合物中存在的共用电子对总数为8NA | |
| C. | 反应N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3中,当净生成0.2mol NH3生产时,在正反应中N2得到0.6NA电子 | |
| D. | 电解精炼铜中,当阴极增重3.2g时,阳极失去电子0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将体积缩小为原来的一半,当体系再次达到平衡时,C02的浓度为原来的2倍 | |
| B. | CaCO3(s)加热分解生成Ca0(s)和C02,△s<0 | |
| C. | 将体积增大为原来的2倍,再次达到平衡时,气体密度不变 | |
| D. | 保持容器体积不变,充入He,平衡向逆反应方向进行. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内2amol A生成,同时生成3amol B | |
| B. | A、B、C的浓度不再变化 | |
| C. | 混合气体的总压强不再变化 | |
| D. | A、B、C的分子数目比为1:3:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com