
【题目】下列说法不正确的是( )
A. 向汽油中添加甲醇后,该混合燃料的热值不变
B. 光催化还原水制氢比电解水制氢更节能环保、更经济
C. 氨氮废水(含NH4+及NH3)可用化学氧化法或电化学氧化法处理
D. 某种光学检测技术具有极高的灵敏度,可检测到单个细胞(V≈10-12L)内的数个目标分子,据此可推算该检测技术能测量细胞内浓度约为10-12~10-11mol·L-1的目标分子
【答案】A
【解析】A.汽油与甲醇均可燃烧,且热值不同,则向汽油中添加甲醇后,该混合燃料的热值发生变化,故A错误;B.电解消耗电能,而光催化还原水制氢可利用太阳能,前者浪费能源,则光催化还原水制氢比电解水制氢更节能环保、更经济,故B正确;C.氨氮废水中N为-3价,可利用氧化还原反应原理发生氧化反应转化为无毒物质,所以可用化学氧化法或电化学氧化法处理,故C正确;D.可检测到单个细胞(V≈10-12L)内的数个目标分子,体积为10-12L,设数个分子为N,则即该检测技术能检测细胞内浓度为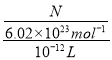 ,N可能介于1~10之间,则约为10-12-10-11molL-1的目标分子,故D正确;故选A。
,N可能介于1~10之间,则约为10-12-10-11molL-1的目标分子,故D正确;故选A。


科目:高中化学 来源: 题型:
【题目】两个容积均为10L的密闭容器Ⅰ和Ⅱ中发生反应:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g),起始物质的量见下表。实验测得两容器不同温度下达到平衡时CO2的物质的量浓度如下图所示,下列说法错误的是
N2(g)+2CO2(g),起始物质的量见下表。实验测得两容器不同温度下达到平衡时CO2的物质的量浓度如下图所示,下列说法错误的是

容器 | 起始物质的量 | ||
NO | CO | ||
Ⅰ | 1mol | 0.5mol | |
Ⅱ | 2mol | 1mol | |
A. 反应N2(g)+2CO2(g)![]() 2NO(g)+2CO(g)的ΔH<0,ΔS>0
2NO(g)+2CO(g)的ΔH<0,ΔS>0
B. P点的速率比M点慢
C. M、N两点容器内的压强: P(M) <2P(N)
D. N点的平衡常数为44.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知元素Se位于第四周期ⅥA族,下列说法不正确的是
A. Se的原子序数为34
B. 单质Se在空气中燃烧可生成SeO3
C. 可形成Na2SeO3、Na2SeO4两种盐
D. H2S比H2Se稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】消除氮氧化物、二氧化硫等物质造成的污染是目前研究的重要课题。
(1)燃煤烟气脱硫常用如下方法。
①用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫。涉及的部分反应如下:2CO(g)+SO2(g)=S(g)+2CO2(g) △H1= + 8.0 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H2=-566.0kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H3=-483.6 kJ·mol-1
则H2(g)还原SO2(g)生成S(g)和H2O(g)的热化学方程式为______________________。
②一氧化碳还原法:在绝热恒容的密闭容器中,反应2CO(g)+SO2(g)![]() S(s)+2CO2(g)达到平衡时,下列说法正确的是____(填序号)。
S(s)+2CO2(g)达到平衡时,下列说法正确的是____(填序号)。
a.容器内气体的压强保持不变 b.分离出S,正反应速率减小
若再充入一定量的CO2,反应的平衡常数不变
③用氨水将SO2转化为NH4HSO3,再氧化成(NH4)2SO4。实验测得NH4HSO3溶液中![]() =15,则溶液的pH为________。 (已知:H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)
=15,则溶液的pH为________。 (已知:H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)
(2)电解NO可以制备NH4NO3,其工作原理如下图所示,阳极的电极反应式为:____________,为使电解产物全部转化为NH4NO3,需补充物质A,A是___________ 。

(3)Na2S是常用的沉淀剂。某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+,滴加Na2S溶液后首先析出的沉淀是________。当最后一种离子沉淀完全时(该离子浓度为10-5 mol·L-1),此时S2-的浓度为_________________________
(已知: Ksp(FeS)=6.3×10-18 ;Ksp(CuS)=6×10-36 ;Ksp(PbS)=2.4×10-28)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,在一烧杯中盛有H2SO4溶液,同时有一表面光滑的塑料小球悬浮于溶液中央,向该烧杯中缓缓注入 Ba(OH)2溶液至恰好完全反应[设H2SO4和Ba(OH)2溶液密度相同]。
试回答

(1)此实验中,观察到的现象有
①_______________________________________________,
②______________________________________________。
(2)写出实验过程中反应的离子方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上或实验室提纯以下物质的方法中不合理的是(括号内为杂质)
A.溴苯(溴):加NaOH溶液,分液
B.苯(甲苯):加入浓溴水,分液
C.乙醇(水):加新制生石灰,蒸馏
D.乙酸乙酯(乙酸、乙醇):加饱和碳酸钠溶液,分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化钙(CaH2)固体是一种储氢材料,是登山运动员常用的能源提供剂。
I 、金属Ca 的部分性质有:
① 常温或加热条件下Ca都能与氧气反应;
② Ca常温遇水立即发生剧烈反应生成氢氧化钙和氢气,并放出大量的热;
③ Ca + H2=CaH2(固体)。
II 、固体CaH2的部分性质有:
① 常温:CaH2+ 2H2O = Ca(OH)2+2H2;②CaH2要密封保存。
(l)写出Ca常温遇水立即发生反应的化学方程式:_________;其中氧化剂为_________(填化学式)。
(2)用双线桥法标明反应CaH2+ 2H2O = Ca(OH)2+2H2中电子转移的方向和数目________________。
(3)取一定质量的钙,平均分成两等份,一份直接与水反应生成氢气,另一份先生成氢化钙,然后氢化钙与水反应生成氢气,如果不考虑中间的损失,理论上两份产生的氢气的物质的量比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 沸点:邻二甲苯>间二甲苯>对二甲苯
B. 鸡蛋淸在NH4Cl溶液中能发生盐析,但是不能和盐酸发生化学反应
C.  有机物A的分子式为C16H16O3
有机物A的分子式为C16H16O3
D.  滴入酸性KMnO4溶液振荡,紫色褪去,能证明其结构中存在碳碳双键
滴入酸性KMnO4溶液振荡,紫色褪去,能证明其结构中存在碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1) 常温下,向 1 L 0.1 mol·L-1 的的醋酸溶液中加入0.1 mol醋酸钠固体,则醋酸的电离平衡向______(填“正”或“逆”)反应方向移动;溶液中c (CH3COO-)·c(H+) / c (CH3COOH) 的值 __________(填“增大”、“减小”或“不变”)。
(2)常温时,测得0.1 mol·L-1 Na2A 溶液的pH=7。
① H2A在水溶液中的电离方程式为 ______________________ 。
② 该温度下,将0.01 mol·L-1 H2A溶液稀释20倍后,溶液的pH= _______ 。
③ 体积相等、pH=1的盐酸与H2A溶液分别与足量的Zn反应,产生的氢气 _________ 。(填序号)
A 、盐酸多 B、 H2A多 C、一样多 D、无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com