
【题目】电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
弱酸 | CH3COOH | HCN | H2CO3 |
电离常数(25℃) | Ka = 1.8×10-5 | Ka=4.3×l0-10 | Ka1=5.0×l0-7 Ka2=5.6×l0-11 |
①0.1 moI/L NaCN溶液和0.1mol/L NaHCO3溶液中,c(CN-)______c(HCO3-)(填“>”、“<”或“=”)。
②常温下,物质的量浓度相同的三种溶液:A.CH3COONa B.NaCN C.Na2CO3,其pH由大到小的顺序是________(填编号)。
③将少量CO2通入NaCN溶液,反应的离子方程式是__________。
④室温下,-定浓度的CH3COONa溶液pH=9,用离子方程式表示溶液呈碱性的原因是______,溶液中c(CH3COO-)/c(CH3COOH) =________。
(2)某温度下, PH=3的盐酸中[OH-]=10-9 mol/L. 该温度下, PH=2的H2SO4与PH=11的NaOH混合后PH变为9,则硫酸与氢氧化钠的体积比为______.
(3)室温下,用0.100 mol/L盐酸溶液滴定20.00mL 0.l00mol/L 的某氨水溶液,滴定曲线如图所示(横坐标为盐酸的体积)。

①d点所示的溶液中离子浓度由大到小的顺序依次为_____。
②b点所示的溶液中c(NH4+)-c(NH3·H2O)=______(写出准确数值)。
(4)在SO2溶于水形成的二元弱酸溶液中,含S元素的某微粒占所有含S元素微粒的物质的量分数与溶液pH的关系如下图所示,该微粒的化学式为_______;该二元弱酸的一级电离常数为Ka1,则pKa1=-lgKa1≈____。

【答案】< CBA CN-+CO2+H2O=HCN+HCO3- CH3COO-+H2O![]() CH3COOH+OH- l.8×104 9: 1 c(C1-)>c(NH4+)>c(H+)>c(OH-) 2c(H+)-2c(OH-) HSO3- 1.91
CH3COOH+OH- l.8×104 9: 1 c(C1-)>c(NH4+)>c(H+)>c(OH-) 2c(H+)-2c(OH-) HSO3- 1.91
【解析】
(1)①根据表格中数据可知,HCN电离出的H+小于H2CO3电离出H+能力,根据盐类水解中越弱越水解,即CN-水解的能力强于HCO3-,因此等浓度的NaCN溶液和NaHCO3溶液中,c(CN-)<c(HCO3-),故答案为:<。
②电离平衡常数越小,酸越弱,因此根据电离平衡常数可知,酸性强弱顺序是CH3COOH>H2CO3>HCN>HCO3-。酸越弱,相应的钠盐越容易水解,溶液的pH越大,则等物质的量浓度的A.CH3COONa、B.NaCN、C.Na2CO3的pH由大到小的顺序为C>B>A,故答案为:CBA。
③HCN的电离平衡常数Ka=4.3×10-10,H2CO3的电离平衡常数是Ka1=5.0×10-7、Ka2=5.6×10-11,由此可知电离出H+能力强弱程度为H2CO3>HCN>HCO3-,所以NaCN溶液通入少量CO2的离子方程式是:CN-+CO2+H2O=HCN+HCO3-,故答案为:CN-+CO2+H2O=HCN+HCO3-。
④CH3COONa是强碱弱酸盐,醋酸根离子水解导致溶液呈碱性,水解离子反应方程式为CH3COO-+H2O![]() CH3COOH+OH-,
CH3COOH+OH-,![]() =
=![]() =
=![]() =l.8×104,故答案为:CH3COO-+H2O
=l.8×104,故答案为:CH3COO-+H2O![]() CH3COOH+OH-,l.8×104。
CH3COOH+OH-,l.8×104。
(2)该温度下,pH=3,即c(H+)=10-3mol/L,而c(OH-)=10-9mol/L,则Ksp=10-12,pH=11的NaOH溶液c(OH-)=0.1mol/L,PH=2的H2SO4溶液c(H+)=0.01mol/L,混合后pH变为9,设酸的体积为V1,碱的体积为V2,则混合溶液中c(OH-)=10-3mol/L=![]() =
=![]() ,V1:V2=9:1,故答案为:9:1。
,V1:V2=9:1,故答案为:9:1。
(3)①d点酸碱恰好完全反应生成氯化铵,氯化铵水解导致溶液呈酸性,c(H+)>c(OH-),结合电荷守恒可得c(NH4+)<c(C1-),但其水解程度较小,d点所示的溶液中离子浓度由大到小的顺序依次为c(C1-)>c(NH4+)>c(H+)>c(OH-),故答案为:c(C1-)>c(NH4+)>c(H+)>c(OH-)。
②b点溶液中存在电荷守恒c(NH4+)+c(H+)=c(OH-)+c(C1-),存在物料守恒:c(NH3·H
(4)溶液中含S的微粒有H2SO3、HSO3-、SO32-,根据题中所给某微粒的物质的量分数随溶液pH变化的图像关系可得该微粒应为HSO3-,![]() ,在pH=1.91时,含HSO3-的物质的量分数为50%,此时可以近似认为c(H2SO3)=c(HSO3-),则Ka1≈c(H+),即pKa1=-lgKa1≈1.91,故答案为:HSO3-,1.91。
,在pH=1.91时,含HSO3-的物质的量分数为50%,此时可以近似认为c(H2SO3)=c(HSO3-),则Ka1≈c(H+),即pKa1=-lgKa1≈1.91,故答案为:HSO3-,1.91。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】用下列实验装置或操作进行相应实验,能达到实验目的的是( )
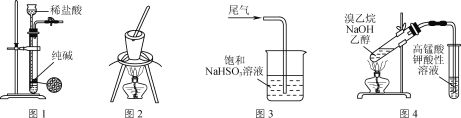
A. 用图1所示装置制取少量纯净的CO2气体
B. 用图2所示装置灼烧碎海带
C. 用图3所示装置吸收尾气中的SO2
D. 用图4所示装置检验溴乙烷与NaOH醇溶液共热产生的乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
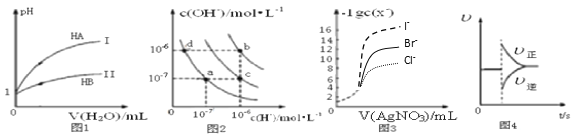
A. 图1表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则等物质的量浓度的NaA和NaB混合溶液中:c(Na+)>c(A-)>c(B-)>c(OH-)>c(H+)
B. 图2中在b点对应温度下,将pH=2的H2SO4溶液与pH=12的NaOH溶液等体积混合后,溶液显中性
C. 用0.0100 mol/L硝酸银标准溶液,滴定浓度均为0.1000 mol/L Cl-、Br-及I-的混合溶液,由图3曲线,可确定首先沉淀的是Cl-
D. 图4表示在N2(g)+3H2(g) ![]() 2NH3(g)达到平衡后,减小NH3浓度时速率的变化
2NH3(g)达到平衡后,减小NH3浓度时速率的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)可用于自来水消毒。以粗盐为原料生产C1O2的工艺主要包括:①粗盐精制;②电解微酸性NaC1溶液;③C1O2的制取。工艺流程如图:

提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液
(1)粗食盐水中含有Ca2+、Mg2+、SO42-等杂质。除杂操作时,往粗盐水中先加入过量的试剂X,选出试剂X所代表的试剂,按滴加顺序依次为是__(填化学式)。
(2)上述过程中,将食盐水在特定条件下电解得到的氯酸钠与盐酸反应生成C1O2。电解时生成的气体B是___:电解时阳极反应式为__。反应Ⅲ的化学方程式为___。
(3)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了以下实验:
步骤1:准确量取ClO2溶液10.00mL,稀释成100mL试样。
步骤2:量取V1mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30分钟。(已知ClO2+I-+H+ I2+Cl-+H2O未配平)
步骤3:以淀粉溶液作指示剂,用cmol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL。(已知:I2+2S2O32-=2I-+S4O62-)
①准确量取10.00mLClO2溶液的玻璃仪器是__。
②上述步骤3中滴定终点的现象是___。
③若实验中使用的Na2S2O3标准溶液部分因被氧气氧化而变质,则实验结果__(填“偏高”、“偏低”或“无影响”)
④根据上述步骤可计算出原C1O2溶液的浓度为__mol·L-1(用含字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )

A.发生的反应可表示为2A(g)![]() 2B(g)+C(g)
2B(g)+C(g)
B.开始时,正、逆反应同时开始
C.前2min内A的分解速率为0.1mol·L-1·min-1
D.2min时,A、B、C的浓度之比为2∶3∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.用惰性电极电解饱和食盐水,阴极逸出的气体可使湿润的淀粉碘化钾试纸变蓝
B.粗铜电解精炼时,若电路中通过2mole-,阳极减少64g
C.用惰性电极电解MgCl2溶液所发生反应的离子方程式为2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
D.在镀件上电镀铜时,镀件应连接电源的负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,0.3molX(g)与Y(g)在容积固定的密闭容器中发生反应:X(g)+3Y(g) ![]() 2Z(g), ΔH=-aKJ/mol,下列说法正确的是
2Z(g), ΔH=-aKJ/mol,下列说法正确的是
A. 反应一段时间后,X与Y的物质的量之比仍为1:1
B. 达到平衡时,且反应放出0.1aKJ的热量
C. 达到平衡后,若向平衡体系中充入西游气体,Z的正反应速率将不发生变化
D. X的体积分数保持不变,说明反应已达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示化学反应过程中的能量变化,据图判断下列说法中合理的是( )
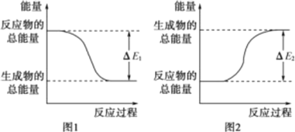
A.铵盐和碱混合即可反应,其能量变化符合图 1
B.0.1mol H2SO4 溶液和 0.1mol Ba(OH)2 溶液的反应符合图 2,且吸收热量为ΔE2
C.0.1mol HCl 溶液和 0.1mol NaOH 溶液的反应符合图 1,且放出热量为ΔE1
D.发生图 1 能量变化的任何反应,一定不需要加热即可发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某液态肼(N2H4)燃料电池被广泛应用于发射通讯卫星、战略导弹等运载火箭中。其中以固体氧化物为电解质,生成物为无毒无害的物质。下列有关该电池的说法正确的是
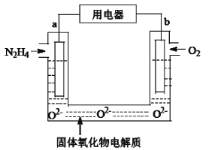
A.b极是正极,发生还原反应
B.电池电路中,电流方向:电极a→用电器→电极b
C.当电极a.上消耗1 mol N2H4时,电极b上被氧化的O2在标准状况下体积为11.2 L
D.b极附近的pH值变大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com