
【化学—选修2:化学与技术】(15分)
I、污水经过一级、二级处理后,还含有少量Cu2+、Hg2+、Pb2+等重金属离子,可加入沉淀剂使其沉淀。下列物质不能作为沉淀剂的是
A.氨水 B.硫化氢气体 C.硫酸钠溶液 D.纯碱溶液
II、合成氨的流程示意图如下:

回答下列问题:
(1)工业合成氨的原料是氮气和氢气。氮气是从空气中分离出来的,通常使用的两种分离方法是 , ;氢气的来源是水和碳氢化合物,写出分别采用煤和天然气为原料制取氢气的化学反应方程式 , ;
(2)设备A中含有电加热器、触煤和热交换器,设备A的名称 ,其中发生的化学反应方程式为 ;
(3)设备B的名称 ,其中m和n是两个通水口,入水口是 (填“m”或“n”)。不宜从相反方向通水的原因 ;
(4)设备C的作用 ;
(5)在原料气制备过程中混有CO对催化剂有毒害作用,欲除去原料气中的CO,可通过如下反应来实现:CO(g)+H2O(g) CO2 (g)+ H2 (g),已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过90%,则起始物中c(H2O):c(CO)不低于 。
CO2 (g)+ H2 (g),已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过90%,则起始物中c(H2O):c(CO)不低于 。
(15分)Ⅰ、AC (2分) Ⅱ、(1) 液化、分馏 ; (1分) 与碳反应除去O2 (1分)
C+H2O H2+CO(1分);CH4+H2O
H2+CO(1分);CH4+H2O 3H2+CO (1分)
3H2+CO (1分)
(2) 合成塔 (1分) (1分)
(1分)
(3)冷却塔(1分);n(1分);高温气体由冷却塔的上端进入,冷却水从下端进入,逆向冷却效果好。(2分) (4)将液氨与未反应的原料气分离。 (1分) (5)13.8 (2分)
【解析】
试题分析:I、A.氨水能与铜离子形成络合物,不能形成沉淀,即氨气不能作为沉淀剂;B.硫化氢气体与三种金属阳离子均反应生成沉淀,可以作为沉淀剂;C.硫酸钠溶液与铜离子不能产生沉淀,不能作为沉淀剂;D.纯碱溶液与三种金属阳离子均产生碳酸盐沉淀,可以作为沉淀剂,答案选AC。
II、(1)由于氮气的沸点低,且空气中含有氧气,所以从空气中分离出氮气通常使用的两种分离方法是液化、分馏和与碳反应除去O2;氢气的来源是水和碳氢化合物,高温下碳与水蒸气反应生成氢气和CO,甲烷在一定条件下也能与水蒸气反应生成氢气和CO,反应的化学方程式分别是C+H2O H2+CO、CH4+H2O
H2+CO、CH4+H2O 3H2+CO。
3H2+CO。
(2)根据装置可知设备A的名称合成塔,其中发生的化学反应方程式为N2+3H2 2NH3。
2NH3。
(3)设备B的名称冷却塔,由于高温气体由冷却塔的上端进入,冷却水从下端进入,逆向冷却效果好,所以入水口是n。
(4)设备C是分离器,及时把将液氨与未反应的原料气分离,有利于平衡向正反应方向进行,提高原料利用率。
(5)设起始物中c(H2O)与c(CO)分别是x与y,则消耗CO是0.9y,生成CO2和氢气均都是0.9y,则根据平衡常数K可知 ,解得x:y=13.8,即起始物中c(H2O):c(CO)不低于13.8。
,解得x:y=13.8,即起始物中c(H2O):c(CO)不低于13.8。
考点:考查化学与技术模块的分析与由于


科目:高中化学 来源:2014-2015学年山东省潍坊市高三12月月考化学试卷(解析版) 题型:选择题
化学与生产、生活密切相关。下列说法正确的是
A.对“地沟油”进行分馏可以获得汽油发动机的燃料
B.用纯碱制玻璃、用铁矿石炼铁都会产生温室气体
C.海水中有大量人类需要的物质,可以大量开发海水中的物质,以解决资源短缺的问题
D.工业上以氯气和澄清石灰水为原料制造漂白粉
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省南通市高三第一次模拟化学试卷(解析版) 题型:选择题
向20mL 0.1mol/L NH4HSO4溶液中滴入0.1mol/L NaOH溶液至恰好反应完全,下列说法正确的是
A.整个反应过程中:c(H+) + c(Na+) + c(NH4+)=c(OH-) + 2c(SO42-)
B.当滴入30mL NaOH溶液时(pH>7):c(NH4+)>c(NH3·H2O)>c(OH-)>c(H+)
C.当滴入20mL NaOH溶液时:2c(SO42-)=c(NH3·H2O)+ c(NH4+)
D.当溶液呈中性时:c(NH4+)>c(SO42-)>c(Na+)>c(H+)= c(OH-)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省枣阳市高三上学期期末考试理综化学试卷(解析版) 题型:填空题
(14分)氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:

(1)图1是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图(a、b均大 于0),且已知: 2CO(g)+2NO(g)=N2(g)+2CO2(g) △H=-c kJ·mol-1(c>0),请写出CO将NO2还原至N2时的热化学方程式 ;
(2)图2是实验室在三个不同条件的密闭容器中合成氨时,N2的浓度随时间的变化曲线(以a、b、c表示)。已知三个条件下起始加入浓度均为:c(N2)=0.1mol·L-1, c(H2)=0.3mol·L-1;
合成氨的反应:N2(g)+3H2(g) 2NH3(g) △H< 0
2NH3(g) △H< 0
①计算在a达平衡时H2的转化率为 ;
②由图2可知,b、c各有一个条件与a不同,则c的条件改变可能是 ; 试写出判断b与a条件不同的理由 ;
(3)利用图2中c条件下合成氨(容积固定)。已知化学平衡常数K与温度(T)的关系如 下表:
T/(K) | 298 | 398 | 498 | …… |
K | 4.1×106 | K1 | K2 | …… |
①试确定K1的相对大小,K 1 4.1× 106(填写“>”“=”或“<”)
②下列各项能作为判断该反应达到化学平衡状态的依据的是 (填序号字母)。
A.容器内NH3的浓度保持不变 B.2υ( N2)正= υ( H2)逆
C.容器内压强保持不变 D.混合气体的密度保持不变
(4)①NH4Cl溶液呈酸性的原因是(用离子反应方程式表示 ) 。
②25℃时,将pH =x氨水与pH =y的硫酸(且x + y = 14, x > 11 )等体积混合后,所得溶液中各种离子的浓度关系正确的是
A.c(SO42-)>c(NH4+)>c(H+)>c(OH-) B.c(NH4+)>c(SO42-)>c(OH-)>c(H+)
C.c(NH4+)+c(H+)>c(SO42-)+c(OH-) D.c(NH4+)>c(SO42-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省枣阳市高三上学期期末考试理综化学试卷(解析版) 题型:选择题
A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X。它们有如下的转化关系(部分产物及反应条件已略去):下列判断正确的是

A.X元素可能为Al
B.X元素不一定为非金属元素
C.反应①和②互为可逆反应
D.反应①和②一定为氧化还原反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省天水市高三第五次检测考试理综化学试卷(解析版) 题型:选择题
pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值。如某溶液溶质的浓度为1×10-3mol/L,则该溶液中溶质的pC=3。下列叙述正确的是
A.某温度下任何电解质的水溶液中,pC(H+) +pC(OH-)=14
B.0.01mol/L的CaCl2溶液中逐滴加入纯碱溶液,滴加过程中pC(Ca2+)逐渐减小
C.用0.01mol/L的盐酸滴定某浓度的NaOH溶液,滴定过程中pC(H+)逐渐增大
D.某温度下,难溶性离子化合物AB的Ksp=1.0×10-10, 其饱和溶液中pC(A+)+pC(B-)=10
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省漳州市八校高三第二次联考化学试卷(解析版) 题型:填空题
选考[化学——选修3:物质结构与性质] (13分)
锂—磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:
2Na3PO4+4CuSO4+2NH3·H2O=Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1)写出基态Cu的价电子排布式 ,与Cu同周期的元素中,与铜原子最外层电子数相等的元素还有 (填元素符号),上述方程式中涉及到的N、O、P、S元素第一电离能由小到大的顺序为 。及电负性由小到大的顺序为 。
(2)氨基乙酸铜的分子结构如图,氮原子的杂化方式为 。
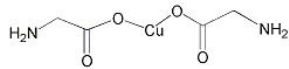
(3)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,则CN-中含有的σ键与π键的数目之比为 。
(4)Cu元素与H元素可形成一种红色化合物,其晶体结构单元如图所示。则该化合物的化学式为 。

查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省漳州市八校高三第二次联考化学试卷(解析版) 题型:选择题
下列各组离子一定能够大量共存的是
A.使紫色石蕊变红的溶液:Fe2+、Mg2+、NO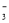 、C1-
、C1-
B.含有较多A13+的溶液:SO42-、Na+、Mg2+、NO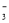
C.含有较多Fe3+的溶液:Na+、SO42-、SCN-、CO32-
D.无色透明的酸性溶液:MnO4—、K+、C1-、HCO3—
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省淮北市高三第一次模拟考试化学试卷(解析版) 题型:选择题
有机化学试剂氨基酸(如图所示)常用语制备磺胺类药物,抗癌药等。下列有关说法正确的是

A.既有酸性也有碱性
B.既能溶于水,又能溶于乙醇
C.分子内σ键与π键数目之比为1:1
D.分子内中所有原子共面
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com