
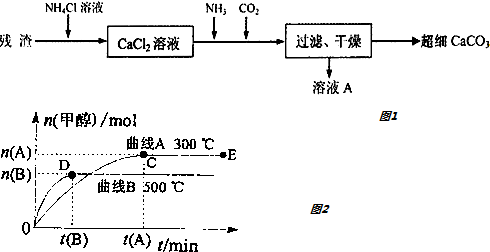
分析 (1)实验室常用碳化钙固体(俗称电石,化学式为CaC2)与水反应制备乙炔;
(2)根据复分解反应的定义,两种化合物相互交换成分,KCl与Ca(ClO3)2能发生复分解反应,说明KClO3在常温下溶解度较小,故可结晶析出,得到其固体;
(3)氯化铵为强酸弱碱盐,水解呈酸性,加入NH4Cl溶液的目的是溶解残渣中的难溶盐CaCO3;由CaCl2+2NH3+CO2+H2O═CaCO3↓+2NH4Cl可知A溶液的化学式为NH4Cl;
(4)①温度升高时甲醇平衡浓度减小,正反应放热;
②根据图中甲醇的变化量,求出氢气的变化量,再根据v(H2)=$\frac{△c}{t}$计算;
③在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,则压强增大,正逆反应速率都增大,平衡向正向移动,甲醇的物质的量增多,氢气的物质的量减小,但由于体积减小,平衡时氢气的浓度反而增大,根据浓度比值等于物质的量比值.
解答 解:(1)实验室常用碳化钙固体(俗称电石,化学式为CaC2)与水反应制备乙炔,同时生成氢氧化钙,该反应的化学方程式为CaC2+2H2O═Ca(OH)2+C2H2↑,
故答案为:CaC2+2H2O→Ca(OH)2+C2H2↑;
(2)根据复分解反应的定义,两种化合物相互交换成分,KCl与Ca(ClO3)2能发生复分解反应,说明KClO3在常温下溶解度较小,故可结晶析出,得到其固体,
故答案为:KClO3的溶解度小;
(3)氯化铵为强酸弱碱盐,水解呈酸性,碳酸钙虽难溶,但在水中存在电离,CaCO3(s)═Ca2++CO32-,加入NH4Cl溶液,NH4Cl溶液显酸性,使CO32-浓度减小,平衡向右移动,CaCO3溶解,加入NH4Cl溶液的目的是溶解残渣中的难溶盐,根据CaCl2+2NH3+CO2+H2O═CaCO3↓+2NH4Cl可知A溶液的化学式为:NH4Cl,可循环使用,
故答案为:CaCO3(s)═Ca2++CO32-,NH4Cl溶液显酸性,使CO32-浓度减小,平衡向右移动,CaCO3溶解;氨气、二氧化碳、NH4Cl溶液;
(4)①温度升高时甲醇物质的量减小,说明正反应放热,故答案为:小于;
②在500℃,平衡时图中甲醇的变化量为nB,所以反应消耗的氢气的量为:2nB,则v(H2)=$\frac{△c}{t}$=$\frac{2{n}_{B}}{3{t}_{{B}_{\;}}}$mol•(L•min)-1,
故答案为:$\frac{2n(B)}{3t(B)}$mol•(L•min)-1;
③在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,则压强增大,正逆反应速率都增大,平衡向正向移动,甲醇的物质的量增多,氢气的物质的量减小,但由于体积减小,平衡时氢气的浓度反而增大,根据浓度比值等于物质的量比值,则有重新平衡时n(H2):n(CH3OH)减小,即bC正确,
故答案为:b c.
点评 本题考查化学平衡移动及其计算,题目难度中等,本题注意外界条件对平衡移动的影响.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 元素X不可能是金属元素 | |
| B. | 元素X的气态氢化物易溶于水 | |
| C. | 元素X能形成化学式为KXO3的盐 | |
| D. | 工业上制取X的单质时一定采用氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
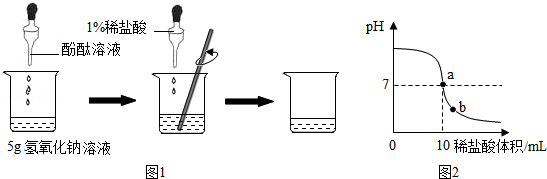
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
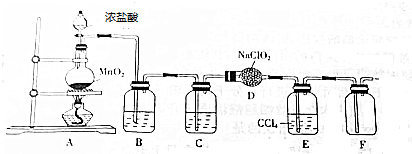
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第一次剩余4.8 g金属为铜和铁 | |
| B. | 稀硝酸的物质的量浓度为1.0 mol•L-1 | |
| C. | 原混合物中铜和铁各0.075 mol | |
| D. | 再加入上述100 mL稀硝酸,又得到标准状况下1.12 L NO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
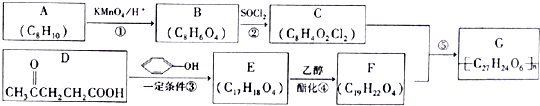
 →
→ +HCl
+HCl ;
;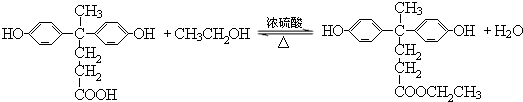 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
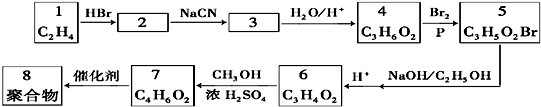

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH(NaOH) | B. | CuCl2(CuO) | C. | NaCl(HCl) | D. | CuSO4(H2O) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com