
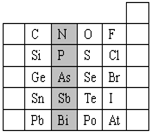
 元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.分析 (1)P位于第三周期VA族;非金属性越强,最高价含氧酸的酸性越强;
(2)原子结构中电子层相同的周期数相同;
(3)同周期从左向右原子半径减小;
(4)最高价氧化物对应水化物中高氯酸的酸性最强;
(5)最外层电子数=最高正价,最低价=最高价-8,非金属性越强越易与氢气化合;
(6)同主族从上到下非金属性减弱,利用单质之间的置换反应可说明.
解答 解:(1)阴影部分元素P在元素周期表中的位置为第三周期 VA 族;非金属性As<N,则酸性H3AsO4<HNO3,故答案为:第三周期 VA 族;<;
(2)从原子结构角度分析,C、N、O、F四种元素处于同一行,是由于它们的电子层数相同,故答案为:电子层数;
(3)同周期从左向右原子半径减小,则r(P)>r(S),故答案为:>;
(4)最高价氧化物对应水化物中高氯酸的酸性最强,其化学式为HClO4,故答案为:HClO4;
(5)最外层电子数=最高正价,最低价=最高价-8,非金属性越强越易与氢气化合,则元素S的最高正价和最低负价分别为+6、-2,在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),因非金属性S>Se,则在相同条件下Se与H2反应的限度更小,
故答案为:+6;-2;更小;
(6)同主族从上到下非金属性减弱,则Cl原子的非金属性强于Br原子的非金属性;其原因是氯原子半径比溴小,易得电子;能证明该结论的化学方程式为Cl2+2 NaBr=2 NaCl+Br2,
故答案为:强于;氯原子半径比溴小,易得电子;Cl2+2 NaBr=2 NaCl+Br2.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子结构与元素位置的关系、化学用语为解答的关键,侧重分析与应用能力的考查,注意原子结构与元素位置的关系,题目难度不大.


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案科目:高中化学 来源: 题型:多选题
| A. | 苯中少量的苯酚可先加适量的浓溴水,使苯酚生成三溴苯酚,再过滤而除去 | |
| B. | 将苯酚晶体放入少量水中,加热时全部溶解,冷却到50℃形成悬浊液 | |
| C. | 苯酚的酸性很弱,不能使指示剂变色,但可以和NaHCO3反应放出CO2 | |
| D. | 苯酚也可以与硝酸发生硝化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 补血剂中铁元素的化合价为+2价 | |
| B. | 铝是人体中的一种微量元素,如果摄入量过多,易患老年痴呆症 | |
| C. | 铝能溶解于氢氧化钠溶液中,而铁不能与氢氧化钠溶液反应 | |
| D. | 铝的导热性比铁强,因而用铝锅煮食物比铁锅好 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 甘油、油脂均能使酸性KMnO4溶液褪色 | |
| B. | 检验C2H5Cl中氯原子时,将C2H5Cl和NaOH溶液混合加热后,加入稀硝酸进行酸化,再加硝酸银溶液,观察现象 | |
| C. | 淀粉水解程度的检验要用到的试剂有:碘水、氢氧化钠、新制氢氧化铜 | |
| D. | 制溴苯应用液溴、铁屑和苯混合,反应中可观察到容器中有大量白色雾气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石灰石溶于盐酸:CaCO3+2 H+→Ca2++H2O+CO2↑ | |
| B. | 氯水滴加到碘化钾溶液中:Cl2+I-→I2+Cl- | |
| C. | 铁和硫酸铜溶液反应:Fe+Cu2+→Fe2++Cu | |
| D. | 醋酸溶液和氢氧化钾溶液混合:CH3COOH+OH-→CH3COO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
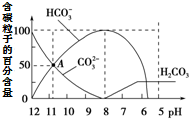 常温下在20mL 0.1mol•L-1 Na2CO3溶液中逐滴加入0.1mol•L-1 HCl溶液40mL,溶液中含碳粒子的百分含量随pH的变化如图所示.下列说法不正确的是( )
常温下在20mL 0.1mol•L-1 Na2CO3溶液中逐滴加入0.1mol•L-1 HCl溶液40mL,溶液中含碳粒子的百分含量随pH的变化如图所示.下列说法不正确的是( )| A. | 0.1 mol•L-1 Na2CO3溶液中:c(OH-)=2c(H2CO3)+c(HCO3-)+c(H+) | |
| B. | A点:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| C. | 0.05 mol•L-1 NaHCO3溶液的pH=8 | |
| D. | pH=7时混合液中c(Na+)=2c(CO32-)+c(HCO3-)+c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液与NaAlO2溶液混合产生白色沉淀,说明结合H+的能力:AlO2->CO32- | |
| B. | 将SO2通入含HClO的溶液中生成H2SO4,说明酸性:HClO>H2SO4 | |
| C. | 浓、稀硝酸与Cu反应的产物分别是NO2和NO,说明氧化性:稀硝酸>浓硝酸 | |
| D. | 高温时C能置换出SiO2中的Si,说明还原性:C>Si |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com