
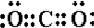 NaCl
NaCl H2O2
H2O2
 NH3:3H•+
NH3:3H•+ →
→ .
. 分析 (1)一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,第IA、第IIA族元素和第VIA、第VIIA族元素之间易形成离子键,单原子分子中不存在化学键;
(2)共价化合物中,原子之间以共用电子对结合形成共价键,离子化合物中,离子之间通过得失电子形成离子键.
(3)氟化钙为离子化合物,阴阳离子需要标出所带电荷,氟离子需要标出最外层电子;氨气为共价化合物,分子中存在3个氮氢键,氮原子最外层达到8电子稳定结构,据此用电子式分别表示出氟化钙、氨气的形成过程.
解答 解:(1)①NaCl中钠离子和氯离子之间只存在离子键;
②NaOH中钠离子和氢氧根离子之间存在离子键、O原子和H原子之间存在共价键;
③N2中N原子之间只存在共价键;
④H2S中H原子和S原子之间只存在共价键;
⑤Na2O2中钠离子和过氧根离子之间存在离子键、O原子和O原子之间存在共价键;
⑥Ar是由单原子构成的,不存在化学键,只存在范德华力;
所以只含有离子键的是①,只含有共价键的是③④,既含离子键又含共价键的是②⑤,没有化学键的是
⑥,
故答案为:①;③④;②⑤;⑥;
(2)根据电子式书写规则知,这几种物质的电子式分别为:CO2: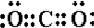 ,NaCl:
,NaCl: ,H2O2:
,H2O2: ,
,
故答案为: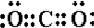 ;
; ;
; .
.
(3)氟化钙为离子化合物,阴阳离子需要标出所带电荷,用电子式表示其形成过程为: ;
;
氨气为共价化合物,分子中存在3个氮氢键,其形成过程为:3H•+ →
→ ,
,
故答案为: ;3H•+
;3H•+ →
→ .
.
点评 本题考查了化学键的判断、电子式的书写,明确化学键的概念、电子式的书写规则是解本题关键,难点是电子式的书写方式,注意离子键和共价键表示的区别,注意稀有气体中不存在化学键,为易错点.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:选择题
| A. | 24Cr的电子排布式:1s22s22p63s23p63d54s1 | |
| B. | K的价电子排布式:4s1 | |
| C. | 氮原子的轨道表示式: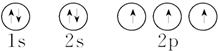 | |
| D. | 硫原子的轨道表示式: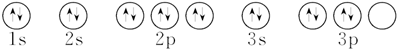 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 75 | 74 |
| 主要化合价 | +2 | +3 | +3、+5、-3 | -2 |
| A. | Y的最高价氧化物对应的水化物显两性 | |
| B. | 一定条件下,Z单质与W的常见单质直接生成ZW2 | |
| C. | X、Y元素的金属性 X<Y | |
| D. | X2+离子半径大于W2-离子半径 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)═N2O4(g) (无色),如图所示.
在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)═N2O4(g) (无色),如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
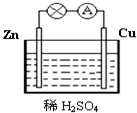 图为原电池的示意图.请回答:
图为原电池的示意图.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
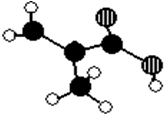 某化工厂生产的某产品A只含C、H、O三种元素,其分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等).
某化工厂生产的某产品A只含C、H、O三种元素,其分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等).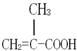 ,含有的官能团名称碳碳双键,羧基.
,含有的官能团名称碳碳双键,羧基. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
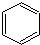
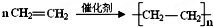 .
.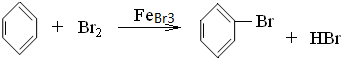 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com