
| 实验目的 | 实验操作 | |
| A | 制备Fe(OH)3胶体 | 将NaOH浓溶液滴加到饱和FeCl3溶液中 |
| B | 由MgCl2溶液制备无水MgCl2 | 将MgCl2溶液加热蒸干 |
| C | 除去Cu粉中混有的CuO | 加入稀硝酸,过滤、洗涤、干燥 |
| D | 用CCl4萃取碘水中的I2 | 先从分液漏斗下口放出有机层,然后从上口倒出水层 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.将NaOH浓溶液滴加到饱和FeCl3溶液中,得到的是氢氧化铁沉淀,不会得到氢氧化铁胶体;
B.镁离子沸水水解生成氢氧化镁和氯化氢,氯化氢易挥发,得到的是氢氧化镁沉淀;
C.稀硝酸能够与铜反应,违反了除杂原则;
D.碘单质易溶于四氯化碳,可以通过分液操作分离.
解答 解:A.制备Fe(OH)3胶体时,应该将饱和氯化铁溶液加入沸水中,然后加热煮沸,而不是将NaOH浓溶液滴加到饱和FeCl3溶液中,故A错误;
B.将MgCl2溶液加热蒸干,应用HCl易挥发,则蒸干后得到的为氢氧化镁,无法获得无水MgCl2,故B错误;
C.除去Cu粉中混有的CuO,铜与稀硝酸反应,不能用稀硝酸,可以用稀盐酸,故C错误;
D.用CCl4萃取碘水中的I2,四氯化碳密度大于水溶液,则有机层在下层,分液时先从分液漏斗下口放出有机层,然后从上口倒出水层,故D正确;
故选D.
点评 本题考查了化学实验方案的评价,题目难度不大,涉及胶体制备、盐的水解原理、物质分离与提纯等知识,明确常见化学实验基本操作方法为解答关键,试题培养了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
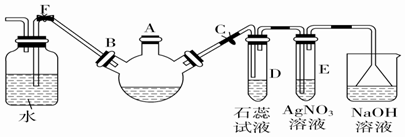
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| I1 | I2 | I3 | I4 | … |
| 496 | 4562 | 6912 | 9540 | … |
 ,含有的化学键类型离子键和共价键,Z2Y2为离子晶体.
,含有的化学键类型离子键和共价键,Z2Y2为离子晶体.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Mg2+、OH-、C1- | B. | Ba2+、K+、CO32-、NO3- | ||
| C. | Na+、K+、C1-、HCO3- | D. | H+、Na+、C1-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca2+、Cl-、CO32-、K+ | B. | Cu2+、Cl-、SO42-、OH- | ||
| C. | K+、Cl-、NO3-、H+ | D. | H +、Cl-、CO32-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、O2、SO3中 | B. | SO3中 | C. | SO2、O2中 | D. | SO2、SO3中 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com