
分析 (1)在一个容积固定不变的密度容器和温度下达到平衡,C在平衡混合气体中的体积分数仍为n%,则新平衡与原平衡等效,但物质的量却为原来的2倍,而该反应是一个反应前后气体物质的量不变的反应,只要按照化学计量数转化成反应物A、B,物质的量分别为4mol、2mol即可;
(2)如果维持条件不变,仅从生成物开始配比,要求达到平衡时,C的物质的量为仍w mol/L则根据等效平衡计算D最少的物质的量,再结合D为固体,增加用量平衡不移动判断.
解答 解:(1)在一个容积固定不变的密度容器和温度下达到平衡,C在平衡混合气体中的体积分数仍为n%,则新平衡与原平衡等效,但物质的量却为原来的2倍,而该反应是一个反应前后气体物质的量不变的反应,只要按照化学计量数转化成反应物A、B,物质的量分别为4mol、2mol即可,
A.4molA+2molB,反应物浓度为原先各反应物浓度的2倍,则达到平衡时,C的物质的量为2w mol,C在平衡混合气体中的体积分数仍为n%,故A正确;
B.6molC+1molD,D为固体,1molD固体可能够达到新平衡的用量,也可能不足,不一定能满足题意,故B错误;
C.1molA+0.5molB+1.5molC+0.5molD,相当于2molA、1molB,与原平衡完全等效,则达到平衡时,C的物质的量为w mol,C在平衡混合气体中的体积分数为n%,故C错误;
D.2molA+1molB+3molC+4molD,D为固体用量多不影响,所以相当于4Amol、2molB,反应物浓度为原先各反应物浓度的2倍,则达到平衡时,C的物质的量为2w mol,C在平衡混合气体中的体积分数仍为n%,故D正确;
E.2molA+1molB+3molC+2molD,D为固体用量多不影响,所以相当于4Amol、2molB,反应物浓度为原先各反应物浓度的2倍,则达到平衡时,C的物质的量为2w mol,C在平衡混合气体中的体积分数仍为n%,故E正确;
故选ADE;
(2)2A(g)+B(g)?3C(g)+D(s)
开始投料量(mol)2 1 0 0
平衡为 w mol $\frac{w}{3}$mol
故D的物质的量最少为$\frac{w}{3}$mol,又D为固体,增加用量平衡不移动,所以D的范围为$\frac{w}{3}$mol<n(D),
故答案为:$\frac{w}{3}$mol<n(D).
点评 本题考查的是等效平衡及化学平衡的有关计算,题目难度较大,注意掌握化学平衡的影响因素,明确等效平衡的使用方法,难度不大.


 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
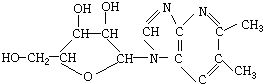 对此结构的下列说法中,正确的是( )
对此结构的下列说法中,正确的是( )| A. | 维生素B12属于无机物 | |
| B. | 维生素B12属于有机物 | |
| C. | 维生素B12属于烃 | |
| D. | 到目前为止,人类只能合成自然界中已存在的有机化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4molA+2molB | B. | 3molC+1molD+1molB | ||
| C. | 3molC+1molD | D. | 1.5molC+0.5molD |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要使用托盘天平称量Na2CO3•10H2O晶体2.86g | |
| B. | 将称量好的Na2CO3•10H2O晶体放入烧杯中,加入100mL蒸馏水,搅拌、溶解 | |
| C. | 转移溶液时应使用玻璃棒引流,且玻璃棒末端应靠在容量瓶刻度线下方 | |
| D. | 定容时,俯视刻度线会使所配制溶液的物质的量浓度偏低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2S+O2═2H2O+2S | B. | 2H2S+3O2═2H2O+2SO2 | ||
| C. | C2H4+3O2═2H2O+2CO2 | D. | C4H8+6O2═4H2O+4CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径B>A>C | B. | 原子序数A>B>C | ||
| C. | 离子半径A2->B2+>C- | D. | 最外层电子数C>A>B |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气通入淀粉碘化钾溶液中,溶液变蓝,氧化性:Cl2>I2 | |
| B. | 久置的氯水最终变为稀盐酸 | |
| C. | NaClO溶液的漂白原理与Na202相同,与SO2不同 | |
| D. | 无色溶液C中加入AgN03溶液,产生白色沉淀,再加入稀盐酸,沉淀不消失,则无色溶液C中一定含有Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com