
分析 (1)NF3,NBr3、NCl3都是分子晶体,且结构相似,根据相对分子质量可判断沸点高低,计算中心原子的价电子对数可判断出中心原子杂化方式及分子空间构型;
(2)N4分子与P4结构相似,为正四面体构型,N4分子中N原子形成3个σ键、含有1对孤对电子,杂化轨道数目为4,每个面为正三角形;
(3)原子个数相等且价电子数相等的微粒为等电子体;
(4)Fe是26号元素,其原子核外有26个电子,其3d轨道上6个电子4s上2个电子为其外围电子,配合物中配体个数为其配位数个数;
(5)结构相似的离子晶体中,晶格能与离子半径呈反比.
解答 解:(1)NF3,NBr3、NCl3都是分子晶体,且结构相似,它们相对分子质量大小关系为:NBr3>NCl3>NF3,所以它们的沸点由高到低的顺序是:NBr3>NCl3>NF3,NF3中N和其它三个F原子形成三对共用电子对,另外还有一对孤电子对,所以氮原子是sp3杂化方式,由于有孤电子对,所以它是三角锥形,
故答案为:NBr3>NCl3>NF3;sp3;三角锥形;
(2)N4分子中N原子形成3个σ键、含有1对孤对电子,杂化轨道数目为4,N原子采取sp3杂化,每个面为正三角形,N-N 键的键角为60°,
故答案为:60°;
(3)N3-中原子个数是3,价电子数是16,则与N3-互为等电子体的分子、离子有:N2O或CO2或CS2或BeCl2;SCN-或OCN-或CNO-,
故答案为:N2O或CO2或CS2或BeCl2;SCN-或OCN-或CNO-;
(4)Fe是26号元素,其原子核外有26个电子,Fe元素基态原子核外电子排布式为1s22s22p63s23p63d64s2,其3d轨道上6个电子为其外围电子,4s上2个电子为其外围电子,其价电子排布式为3d64s2,配合物Co[(N3)(NH3)5]SO4中Co3+原子含有空轨道,N原子含有孤电子对,Co的配位数为6,
故答案为:3d64s2;6;
(5)NaN3与KN3的结构类似,钠离子半径小于钾离子半径,所以NaN3的晶格能>KN3的晶格能,
故答案为:>.
点评 本题考查了物质结构与性质,涉及杂化方式、等电子体原理、配合物、晶格能等知识的掌握情况,对学生综合运用物质结构知识解决问题的能力有一定的要求,题目难度中等.


科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的 |
| A | 加入足量铜粉、搅拌、过滤 | 除去CuCl2溶液中少量的FeCl3 |
| B | 在NaHCO3溶液中滴加H2C2O4溶液 | 比较H2C2O2与H2CO3的酸性强弱 |
| C | 将气体通入AgNO3溶液 | 检验H2S气体中存在HCl杂质 |
| D | 在坩埚中加热至恒重 | 除去BaSO4中少量的BaSO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12 | B. | 17 | C. | 20 | D. | 30 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该电池的电解质溶液为酸性 | B. | 电池总反应为2H2+O2=2H2O | ||
| C. | X极是负极,发生氧化反应 | D. | 电池工作一段时间后溶液PH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由反应①知H2的燃烧热为571.6kJ/mol | |
| B. | 反应②中生成物的总能量高于反应物的总能量 | |
| C. | 反应③若改用新催化剂,△H3不变化 | |
| D. | 反应CH4(g)═C(s)+2H2(g)的△H=+74.8kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
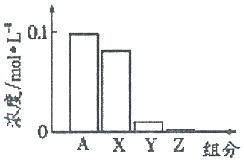 常温下,0.2moI•L-l的Na2CO3溶液与0.2moI•L-l的盐酸等体积混合后,所得溶液中部分微粒组分与浓度的关系如图所示,X、Y、Z均表示含碳微粒,下列说法正确的是( )
常温下,0.2moI•L-l的Na2CO3溶液与0.2moI•L-l的盐酸等体积混合后,所得溶液中部分微粒组分与浓度的关系如图所示,X、Y、Z均表示含碳微粒,下列说法正确的是( )| A. | A代表Na+浓度 | |
| B. | 该溶液中c(OH-)>c(Y) | |
| C. | 向该溶液中加水稀释,所有离子浓度均减小 | |
| D. | 该混合溶液中:c(X)+c(Y)+c(Z)═2c(Na+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com