
分析 A、B、C、D、E是周期表前四周期的元素,原子序数依次增大.A的基态原子2p能级有3个单电子,原子核外电子排布式为1s22s22p3,则A为N元素;C的基态原子2p能级有1个单电子,原子核外电子排布式为1s22s22p5,则C为F元素;B的原子序数介于氮、氟之间,故B为O元素;E位于ds区,最外能层有单电子,则E为Cu;D与E不同周期,但最外能层电子数相等,D处于第三周期,则D为Na.
解答 解:A、B、C、D、E是周期表前四周期的元素,原子序数依次增大.A的基态原子2p能级有3个单电子,原子核外电子排布式为1s22s22p3,则A为N元素;C的基态原子2p能级有1个单电子,原子核外电子排布式为1s22s22p5,则C为F元素;B的原子序数介于氮、氟之间,故B为O元素;E位于ds区,最外能层有单电子,则E为Cu;D与E不同周期,但最外能层电子数相等,D处于第三周期,则D为Na.
(l)基态E原子的价电子排布式为3d104s1,故答案为:3d104s1;
(2)同周期随原子序数增大,元素第一电离能呈增大趋势,氮元素2p能级为半满稳定状态,能量较低,第一电离能高于氧元素的,故三种元素第一电离能由大到小的顺序为F>N>O,
故答案为:F>N>O;
(3)B、C两元素形成的化合物FO2中F原子孤电子对数=$\frac{7-2×2}{2}$=1.5,应看作2对孤对电子,价层电子对数为4,VSEPR模型名称为四面体形,FO2和H2O分子均为V形分子,且孤对电子均为2对,F与O的电负性差值较O与H的电负性差值小,OF2分子的极性比水分子的极性弱,
故答案为:四面体形;FO2和H2O分子均为V形分子,且孤对电子均为2对,F与O的电负性差值较O与H的电负性差值小;
(4)由N和O两种元素形成的与N3-互为等电子体的粒子的化学式有N2O、NO2+等,
故答案为:N2O、NO2+;
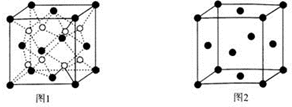
(5)晶胞中白色球数目为8,黑色球数目为8×$\frac{1}{8}$=6×$\frac{1}{2}$=4,该化合物为Na2O,晶胞质量为4×$\frac{62}{{N}_{A}}$g,则晶胞密度为4×$\frac{62}{{N}_{A}}$g÷(n cm)3=$\frac{248}{{a}^{3}{N}_{A}}$g/cm3,
故答案为:$\frac{248}{{a}^{3}{N}_{A}}$;
(6)晶胞中E原子数目为8×$\frac{1}{8}$=6×$\frac{1}{2}$=4,设E原子半径为r,则4r=$\sqrt{2}$b,故原子半径r=$\frac{\sqrt{2}}{4}$b,则E原子在晶胞中的空间利用率为$\frac{4×\frac{4}{3}×π×(\frac{\sqrt{2}}{4}b)^{3}}{{b}^{3}}$=$\frac{\sqrt{2}}{6}$π,
故答案为:$\frac{\sqrt{2}}{6}$π.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电离能、价层电子对互斥理论、等电子体、晶胞计算等,注意同周期第一电离能异常情况,理解均摊法进行晶胞计算.


科目:高中化学 来源: 题型:选择题
| A. | 在化工生产中应遵循“绿色化学”的思想 | |
| B. | 在元素周期表的过渡元素中寻找优良的催化剂 | |
| C. | 汽车尾气中产生NO的原因是空气中的N2与O2在汽车汽缸内的高温环境下发生反应的产物 | |
| D. | 根据元素周期律,由HClO4可以类推出氟元素也存在最高价氧化物的水化物HFO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/×10-3 mol•L-1 | 1.00 | 0.45 | 0.25 | 0.15 | 0.10 | 0.10 |
| c(CO)/×10-3 mol•L-1 | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
| A. | 2 s 内的平均反应速率υ(N2)=1.875×10-4 mol•L-1•s-1 | |
| B. | 在该温度下K=5 | |
| C. | 若将容积缩小为原来的一半,NO 转化率大于90% | |
| D. | 某时刻再充入0.1 mol NO,0.36 mol CO,重新达平衡后CO 浓度比原平衡大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
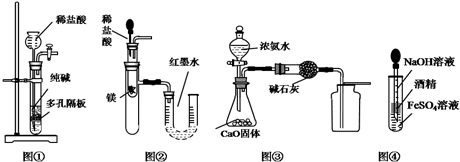
| A. | 用图①所示装置制取少量纯净的CO2气体 | |
| B. | 用图②所示装置验证镁和盐酸反应的热效应 | |
| C. | 用图③所示装置制取并收集干燥纯净的NH3 | |
| D. | 用图④装置制备Fe(OH)2并能保证较长时间观察到白色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.3mol | B. | 0.4mol | C. | 0.5mol | D. | 0.6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 充电过程是化学能转化为电能的过程 | |
| B. | 充电时阳极反应:Ni(OH)2-e-+OH-═NiOOH+H2O | |
| C. | 放电时负极附近溶液的酸性增强 | |
| D. | 放电时电解质溶液中的OH-向正极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
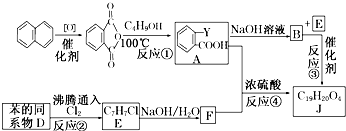
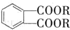 (代号DMP)是一种常用的酯类塑化剂,其蒸气对氢气的相对密度为97.工业上生产DMP的流程如图所示:
(代号DMP)是一种常用的酯类塑化剂,其蒸气对氢气的相对密度为97.工业上生产DMP的流程如图所示: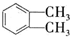 $→_{①光照}^{Cl_{2}}$[A]$\stackrel{②}{→}$[B]$→_{③△}^{Cu、O_{2}}$[C]$\stackrel{④}{→}$[D]$→_{⑤ROH/△}^{浓硫酸}$[DMP]
$→_{①光照}^{Cl_{2}}$[A]$\stackrel{②}{→}$[B]$→_{③△}^{Cu、O_{2}}$[C]$\stackrel{④}{→}$[D]$→_{⑤ROH/△}^{浓硫酸}$[DMP]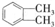 的名称1,2-二甲苯(或邻二甲苯),C中官能团的名称为醛基,DMP的分子式为C10H10O4.
的名称1,2-二甲苯(或邻二甲苯),C中官能团的名称为醛基,DMP的分子式为C10H10O4.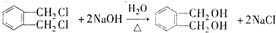 .
. .
. 制备DMP的另一种途径:
制备DMP的另一种途径: $→_{O_{2}①}^{催化剂、△}$
$→_{O_{2}①}^{催化剂、△}$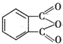 $→_{F②}^{适当条件}$[DMP]
$→_{F②}^{适当条件}$[DMP]查看答案和解析>>
科目:高中化学 来源: 题型:解答题
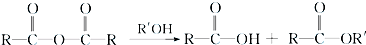
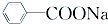 +RCl→
+RCl→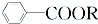 +NaCl;
+NaCl; .
. .
.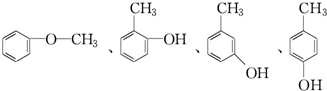 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑦ | B. | ①②③④ | C. | ①③④⑤ | D. | ①④⑥⑦⑧ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com