
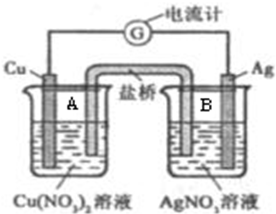
 某原电池构造如图所示.其电池的总反应是:Cu(s)+2Ag+(aq)=Cu2+(aq)+2Ag(s).请回答以下问题:
某原电池构造如图所示.其电池的总反应是:Cu(s)+2Ag+(aq)=Cu2+(aq)+2Ag(s).请回答以下问题:

科目:高中化学 来源: 题型:
| A、0.21 mol |
| B、0.25 mol |
| C、0.3 mol |
| D、0.35 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 现象 | 原因或结论 |
| A | 在 H2O2中加入MnO2,能加速H2O2的分解速率 | MnO2降低了反应所需的活化能 |
| B | 向5mL 0.005mol?L-1FeCl3溶液中加入5mL 0.015mol?L-1KSCN溶液,溶液呈红色,再滴加几滴1mol?L-1KSCN溶液,溶液颜色加深 | 增大反应物浓度,平衡向正反应方向移动 |
| C | 将盛有NO2气体的密闭容器浸泡在热水中,容器内气体颜色变深 | 该反应△H<0,平衡向生成NO2方向移动 |
| D | 在密闭容器中有反应:A+xB(g)?2C(g).达到平衡时测得c(A)为0.5mol/L,将容器容积扩大到原来的两倍,测得c(A)为0.4mol/L-1 | A非气体、x=1 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaClO、HClO都易溶于水 |
| B、HClO与Na2SO3溶液反应,可以得到Na2SO4 |
| C、NaClO的电离方程式:NaClO=Na++ClO- |
| D、0.01 mol?L-1 的HClO溶液pH>2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaOH、Ca(OH)2、NH3?H2O |
| B、NH4Cl、CH3COOH、Na2S |
| C、HBr、HCl、BaSO4 |
| D、HClO、NaF、Ba(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶于硝酸银溶液,观察是否有白色沉淀生成 |
| B、溶于水做导电实验,观察是否导电 |
| C、熔融状态,做导电实验,观察是否导电 |
| D、测定氯化铍熔点 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 425 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com