
| A. | 空气,熟石灰,盐酸 | B. | 青铜,纯碱,水玻璃 | ||
| C. | 石英,二氧化硫,硫酸 | D. | 液氯,烧碱,漂白粉 |
分析 由同一种元素组成的纯净物是单质;
电解质:在水溶液中或熔融状态下能够导电的化合物;
混合物是由两种或多种物质混合而成的物质.
解答 解:A.空气是不同群体组成的混合物,熟石灰是氢氧化钙,在熔融状态下能够导电,是电解质,盐酸是氯化氢的水溶液,是混合物,故A错误;
B.青铜是合金属于混合物不是单质,纯碱是碳酸钠在熔融状态下能够导电是电解质,水玻璃是硅酸钠的水溶液是混合物,故B错误,
C.石英主要成分是SiO2,SiO2是化合物,二氧化硫本身不能电离,是非电解质,硫酸是化合物,是纯净物,故C错误;
D.液氯是液体的氯气是单质,烧碱是氢氧化钠,在熔融状态下能够导电是电解质,漂白粉的主要成分是氯化钙和次氯酸钙是混合物,故D正确;
故选D.
点评 本题重点考查单质、电解质、混合物概念的辨析,难度不大.要注意电解质必须是本身能够电离的化合物.


 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 陶瓷的主要成分是硅酸盐 | B. | 硅可用作半导体材料 | ||
| C. | 电解氯化钠溶液制取金属钠和氯气 | D. | 铁槽可存放冷的浓硝酸、浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
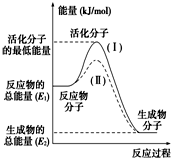 在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示.请认真观察如图,然后回答问题:
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示.请认真观察如图,然后回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用分液的方法分离碘和四氯化碳 | |
| B. | 利用丁达尔效应鉴别 Fe(OH)3胶体和FeCl3溶液 | |
| C. | 加稀盐酸后过滤,除去混在铜粉中的少量镁粉和铝粉 | |
| D. | 用加热的方法除去Na2CO3固体中少量的NaHCO3粉末 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com