
在一定温度下,在一体积固定的密闭容器中加入2 mol X和1 mol Y,发生如下反应:
2X(g)+Y(g)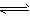 a Z(g)+W(g) ΔH=-Q kJ·mol-1(Q>0)
a Z(g)+W(g) ΔH=-Q kJ·mol-1(Q>0)
当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;平衡后再升高温度,混合气体的平均相对分子质量减小,则
(1)温度升高,平衡常数K的值是____________(填“增大”、“减小”或“不变”)。
(2)化学计量数a的值为____________。
(3)有同学认为,Q1一定小于Q,你认为该结论是否正确?____________其理由是__________________________________。
(4)维持温度不变,若起始时向容器中加入的物质的量如下列各项,则反应达到平衡后放出的热量仍为Q1kJ的是____________(稀有气体不参与反应)。
A.2 mol X、1 mol Y、1 mol Ar
B.a mol Z、1 mol W
C.1 mol X、0.5 mol Y、0.5a mol Z、0.5 mol W
D.2 mol X、1 mol Y、1 mol Z
(5)X的转化率α=____________(用含Q、Q1的代数式表示)。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解

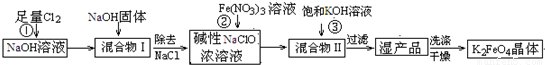
 4Fe(OH)3+8OH-+3O2↑.在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用
4Fe(OH)3+8OH-+3O2↑.在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题


查看答案和解析>>
科目:高中化学 来源:2014届江苏省高三上学期第一次月考化学试卷(解析版) 题型:填空题
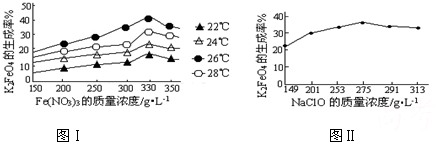
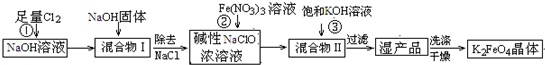
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。工业上常采用NaClO氧化法生产,其生产工艺如下:
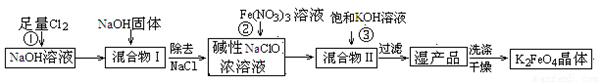
主要反应为:3NaClO+2Fe(NO3)3+10NaOH = 2Na2FeO4↓+3NaCl+6NaNO3+5H2O
Na2FeO4+2KOH=K2FeO4+2NaOH。
(1)写出反应①的离子方程式: 。
(2)从“混合物II”中分离出K2FeO4后,会有副产品,它们都是重要的化工产品,其中一种在工业上用作氯碱工业原料的物质是 。
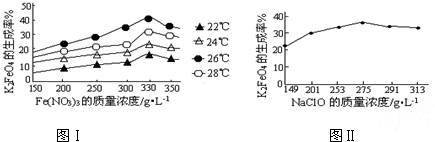
(3)反应的温度、原料的浓度和配比对高铁酸钾的产率都有影响。图Ⅰ为不同的温度下,Fe(NO3)3不同质量浓度对K2FeO4生成率的影响;图Ⅱ为一定温度下,Fe(NO3)3质量浓度最佳时,NaClO浓度对K2FeO4生成率的影响。
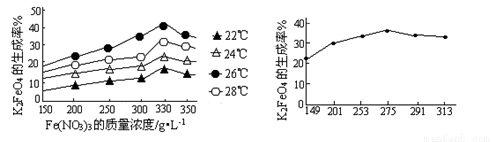
图Ⅰ 图Ⅱ
根据上图分析:工业生产中最佳温度为 ℃,此时Fe(NO3)3与NaClO两种溶液最佳质量浓度之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 4Fe(OH)3+8OH-+3O2↑.在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用______溶液(填序号).
4Fe(OH)3+8OH-+3O2↑.在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用______溶液(填序号).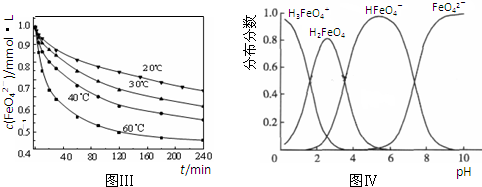
查看答案和解析>>
科目:高中化学 来源:2011年福建省泉州五中高考化学模拟试卷(解析版) 题型:解答题
 4Fe(OH)3+8OH-+3O2↑.在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用______溶液(填序号).
4Fe(OH)3+8OH-+3O2↑.在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用______溶液(填序号).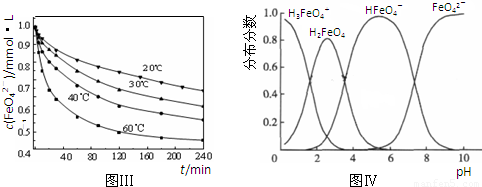
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com