
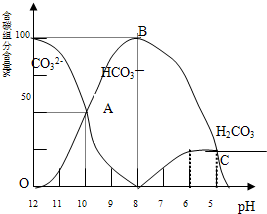
 常温下在20mL 0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示:回答下列问题:
常温下在20mL 0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示:回答下列问题:
| ||
| 0.02L |


科目:高中化学 来源: 题型:阅读理解
| 滴定次数 实验数据 |
1 | 2 | 3 | 4 |
| V(醋酸溶液)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)/mL(初读数) | 0.00 | 0.200 | 0.10 | 0.00 |
| V(NaOH)/mL(终读数) | 14.98 | 15.20 | 15.12 | 15.95 |

查看答案和解析>>
科目:高中化学 来源:2015届广东省广州市四校高二上学期期末联考化学试卷(解析版) 题型:填空题
在常温下向20mL 0.1 mol·L-1 某酸(用HAc表示)溶液中逐滴加入0.1 mol·L-1 NaOH溶液,用pH计来测定溶液中pH数据如下表,作出pH与NaOH溶液体积关系的曲线如图所示(忽略温度变化)。请根据表中数据和滴定曲线回答以下问题:
|
V(NaOH)mL |
0.00 |
10.00 |
18.00 |
19.80 |
19.98 |
20.00 |
20.02 |
20.20 |
22.00 |
40.00 |
|
pH |
3.0 |
4.7 |
5.7 |
6.7 |
7.7 |
8.7 |
9.7 |
10.7 |
11.7 |
12.5 |
(1)实验中的指示剂最好使用___________________________;
(2)当V (NaOH)=20.00mL时,请写出溶液中主要存在的两种平衡状态的表示式_______________、________________;溶液中离子浓度由大到小的顺序是___________________;
(3)a、b、c、d四点对应溶液中水的电离程度由大到小的顺序是_________________。
(4)该温度下,滴定曲线上c点时HAc的电离平衡常数Ka=_______(用含V的代数简式表示)。

查看答案和解析>>
科目:高中化学 来源:同步题 题型:填空题
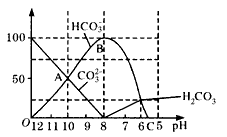
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下在20mL 0.1mol/L Na2CO3溶液中逐滴加入0.1mol/ L HC1溶液40mL,溶液的PH值逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如下图所示回答下列问题:
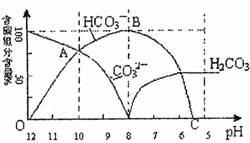
(1) 在0.1mol/L Na2CO3溶液所有阳离子和阴离子的浓度有何关系?(用等式表示)
。
(2)当加入盐酸使溶液PH值为10时,混合液中含碳元素的离子物质的量之比为 。
(3)随着盐酸的加入,请写出BC段的离子方程式 。
(4)当混合液的PH= 时,开始放出CO2气体。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com