
【题目】下列递变规律不正确的是
A.Na、Mg、Al原子的失电子能力逐渐减弱
B.Si、P、S元素的最高正化合价依次降低
C.C、N、O的原子半径依次减小
D.Cl、Br、I的气态氢化物的稳定性依次减弱
科目:高中化学 来源: 题型:
【题目】根据海水综合利用的工业流程图,判断下列说法不正确的是( )

A. 除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序为:NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤后加盐酸
B. 在过程②中将MgCl2·6H2O灼烧即可制得无水MgCl2
C. 从能量转换角度看,氯碱工业电解饱和食盐水是一个将电能转化为化学能的过程
D. 从第④步到第⑤步的目的是富集Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、环境、材料信息关系密切,下列说法不正确的是
A. 锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理,后用酸除去
B. 有一种新发现的固态碳,这种碳的结构称为“纳米泡沫”,外形类似海绵,密度小且有磁性。这种碳与金刚石的关系是互为同素异形体
C. 聚乙炔用I2或Na 等掺杂处理后可形成一种导电塑料,该导电塑料有固定的熔、沸点
D. 工业上电解熔融的氯化钠、氯化镁、氧化铝来制取钠、镁、铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将0.05 mol Na2CO3固体溶于水配成100mL溶液,向溶液中加入下列物质。有关结论正确的是
加入的物质 | 结论 | |
A | 50mL 1 mol/LH2SO4 | 反应结束后,c(Na+)=c(SO42-) |
B | 0.05molCaO | 溶液中c(OH-) /c(HCO3-) 增大 |
C | 50mL H2O | 由水电离出的c(H+)·c(OH—)不变 |
D | 0.1molNaHSO4固体 | 反应完全后,溶液pH减小,c(Na+)不变 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)某研究小组用如图装置进行SO2与FeCl3溶液反应的相关实验(夹持装置已略去)。
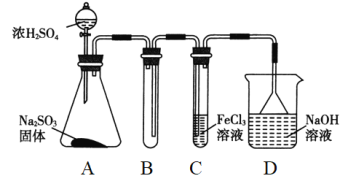
(1)通入足量SO2时C中观察到的现象是______________________。
(2)根据以上现象,该小组同学认为SO2与FeCl3溶液发生氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式:_______________________;
②请设计实验方案检验有Fe2+生成:_________________________;
③该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42-。该做法_____(填“合理”或“不合理”),理由是______。
(3)D装置中倒置漏斗的作用是__________________________。
(4)为了验证SO2具有还原性,实验中可以代替FeCl3的试剂有________(填字母)。
a.浓H2SO4 b.酸性KMnO4溶液 c.碘水 d.NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】初中阶段:物质得氧和失氧的反应是氧化还原反应;高中阶段:凡是有元素化合价升降的化学反应都是氧化还原反应。元素化合价升高的为还原剂,发生氧化反应;元素化合价降低的为氧化剂,发生还原反应;氧化反应和还原反应同时发生的,这样的反应称为氧化还原反应。请回答下列问题:
(1)根据化合价改变判断下列四种基本反应类型,一定不是氧化还原反应的是____。(选填宇母序号)
A.化合反应B.分解反应C.置换反应 D.复分解反应
(2)在化学反应Fe+CuSO4=Cu+FeSO4中,该反应的还原剂是_____(填化学式)。
(3)下列反应中,氧化反应与还原反应在同一元素中进行的是________。(多选,选填字母序号)
A.C12+2NaOH=NaCl+NaClO+H2OB.4P+5O2![]() 2P2O5
2P2O5
C.Zn+CuCl2=Cu+ZnCl2 D.3NO2+H2O=2HNO3+NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯仿(CHCl3)不溶于水,但在一定条件下水解生成两种酸,其中一种是甲酸(HCOOH)。在19世纪氯仿广泛用于麻醉,可由“乙醛漂白粉法”制得。在光照条件下,氯仿易被空气氧化生成剧毒光气(COCl2)和一种化合物。因此氯仿需要小口钢罐贮存运输,使用前要检验其是否变质。
(1)CHCl3的电子式为__________,HCOOH中C的杂化方式为__________;
(2)漂白粉中三种元素的简单离子的半径的大小顺序为__________(用离子符号表示);
(3)氯仿不溶于水而甲酸易溶于水的原因是__________;
(4)Fe2+的外围电子排布图为__________;
(5)纯铁的一种同素异形体的晶胞为面心立方晶胞,该晶体中原子的配位数为__________,若铁原子的半径为a cm,则该晶体的密度为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】24mL浓度为0.05mol/L的Na2SO3溶液,恰好与20mL浓度为0.02mol/L的 K2Cr2O7 溶液完全反应,则元素Cr在还原产物中的化合价是( )
A.+6
B.+3
C.+2
D.0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com