
【题目】在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)![]() CO(g)+H2O(g),
CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K = 。
(2)该反应为 反应(选填“吸热”、“放热”)。
(3)能说明该反应达到化学平衡状态的是 。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:3c(CO2)·c(H2)=5c(CO)·c(H2O),试判断此时的温度为 ℃。
(5)830℃时,在1L密闭容器中分别投入lmolH2和1molCO2反应达到化学平街时,CO2的转化率为 保持温度不变.在平衡体系中再充入1molH2和1 molCO2重新达到化学平衡时,CO2 的平衡转化率 (填“增大”“减小”或“不变”)。
【答案】(1)c(CO)·c(H2O)/c(CO2)·c(H2);(2)吸热;
(3)b、c;(4)700;(5)50%,不变。
【解析】
试题分析:(1)根据化学平衡常数的定义,K=c(CO)×c(H2O)/[c(CO2)×c(H2)];(2)化学平衡常数只受温度的影响,根据表格数据,随着温度的升高,化学平衡常数增大,说明升高温度,平衡向正反应方向移动,根据勒夏特列原理,正反应方向是吸热反应;(3)a、因为反应前后气体系数之和相等,因此压强不变,不能说明达到平衡,故错误;b、根据化学平衡状态的定义,当组分的浓度不再改变,说明反应达到平衡,故正确;c、用不同物质的反应速率表示达到平衡,要求反应反应方向是一正一逆,且反应速率之比等于化学计量数之比,v逆(H2O)向逆反应方向进行,v正(H2)说明向正反应方向进行,当两者相等说明反应达到平衡,故正确;d、没有开始投入量,因此不能说明达到平衡,故错误;(4)3c(CO2)·c(H2)=5c(CO)·c(H2O)变形得出:c(CO)×c(H2O)/[c(CO2)×c(H2)]=3:5=0.6,对应温度是700℃;
(5) CO2(g) + H2(g)![]() CO(g)+H2O(g)
CO(g)+H2O(g)
起始: 1 1 0 0
变化: x x x x
平衡: 1-x 1-x x x
根据化学平衡常数的表达式,K=x2/(1-x)2=1,解得x=0.5,CO2的转化率为0.5/1×100%=50%,因为反应前后气体系数之和相等,因此再充入1molH2和1molCO,和原平衡为等效平衡,CO2的转化率不变。


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】北京2008年奥运会金牌“金镶玉”环形玉壁由昆仑玉制成,昆仑玉的成分可简单看成是
Ca2Mg5Si8O22(OH)2,则其用二氧化硅和金属氧化物的形式可表示为
A.CaO·MgO·SiO2·H2O B.2CaO·5MgO·8SiO2·H2O
C.2CaO·MgO·SiO2·2H2O D.5CaO·2MgO·8SiO2·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,错误的是( )
A.虽然固体氯化钠不能导电,但氯化钠是强电解质
B.碳酸钙难溶于水,碳酸钙不是电解质
C.在醋酸钠溶液中加入少量氢氧化钠,溶液中c(OH-)增大
D.电离平衡常数表征了弱电解质的电离能力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组只领取下列仪器和用品:铁架台、铁夹、铁圈、三角架、石棉网、烧杯、漏斗、分液漏斗、 酒精灯、玻璃棒、量筒、蒸发皿、锥形瓶、牛角管、火柴。不能进行的实验操作是( )
A. 蒸发 B. 萃取 C. 过滤 D. 蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将NO2、NH3、O2混合气22.4L通过稀硫酸后,溶液质量增加了26.7g,气体体积缩小为4.48L(气体均在标准状况下测定)剩余气体能使带火星的木条着火,则混合气体的平均相对分子质量为
A.30.1 B.31.1 C.32.1 D.33.1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 氯气可用于合成药物 B. 碳酸钠可用于治疗胃酸过多
C. 高压钠灯常用来广场照明 D. 镁合金密度小强度大可用于制飞机零部件
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化硼的熔点为-107℃,沸点为12.5℃,在其分子中键与键之间的夹角为120o,它能水解,有关叙述正确的是 ( )
A. 氯化硼液态时能导电而固态时不导电 B. 硼原子以sp杂化
C. 氯化硼遇水蒸气会产生白雾 D. 氯化硼分子属极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨反应为:N2(g)+3H2(g)![]() 2NH3(g).图1表示在一定的温度下此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线.图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响.下列说法正确的是
2NH3(g).图1表示在一定的温度下此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线.图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响.下列说法正确的是
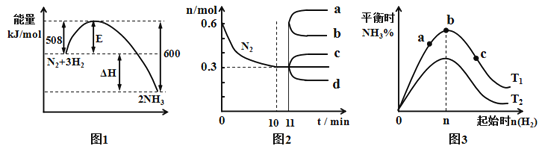
A.由图1可知2NH3(g)![]() N2(g)+3H2(g) △H=-92kJ·mol-1
N2(g)+3H2(g) △H=-92kJ·mol-1
B.图2中0~10min内该反应的平均速率v(H2)=0.09mol·L-1·min-1
C.图2中从11min起其它条件不变,压缩容器的体积,则n(N2)的变化曲线为d
D.图3中温度T1<T2,a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是b点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com