
| A. | 碳酸氢钠的水解反应:HCO3-+OH-?CO32-+H2O | |
| B. | 向澄清石灰水中加入盐酸:Ca(OH)2+2H+═Ca2++2H2O | |
| C. | Cl2通入热的KOH溶液中制取KClO3:3Cl2+6OH-$\frac{\underline{\;\;△\;\;}}{\;}$ClO3-+5Cl-+3H2O | |
| D. | 苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O-→2C6H5OH+CO32- |
分析 A.碳酸氢根离子水解反应生成碳酸和氢氧根离子;
B.澄清石灰水中,氢氧化钙应拆成离子形式;
C.Cl2通入热的KOH溶液发生歧化反应生成氯酸钾和氯化钾、水;
D.苯酚钠溶液中通入少量CO2反应生成苯酚和碳酸氢钠.
解答 解:A.碳酸氢钠的水解反应,离子方程式:HCO3-+OH-?H2CO3+OH-,故A错误;
B.向澄清石灰水中加入盐酸,离子方程式:OH-+H+═H2O,故B错误;
C.Cl2通入热的KOH溶液中制取KClO3,离子方程式:3Cl2+6OH-$\frac{\underline{\;\;△\;\;}}{\;}$ClO3-+5Cl-+3H2O,故C正确;
D.苯酚钠溶液中通入少量CO2,离子方程式:CO2+H2O+C6H5O-→C6H5OH+HCO3-,故D错误;
故选:C.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意苯酚酸性弱于碳酸,题目难度不大.


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:解答题
| 离子 | H+ | Na+ | NH4+ | NO3- | SO42- |
| 浓度(mol/L) | 1×10-5 | 2×10-5 | 3×10-5 | 4×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
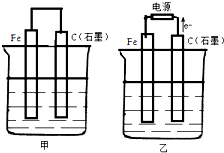 如图甲、乙是电化学实验装置.
如图甲、乙是电化学实验装置.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 操 作 | 现 象 |
通入氯气至过量 | I.A中溶液变红 II.稍后,溶液由红色变为黄色 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
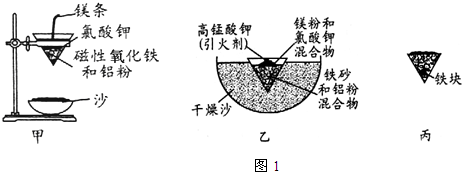
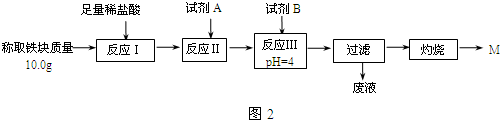
| Fe2+ | Fe3+ | Al3+ | Mg2+ | |
| 开始沉淀时的pH | 7.5 | 2.8 | 4.2 | 9.6 |
| 沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | ① | ② |
| pH | 12 | 12 |
| 溶液 | 氨水 | 氢氧化钠溶液 |
| A. | ①②两溶液中c(OH-)相等 | |
| B. | ①②两溶液分别加水稀释10倍,稀释后溶液的pH:①>② | |
| C. | ①溶液的物质的量浓度为0.01mol•L-1 | |
| D. | 等体积的①②两溶液分别与0.01 mol•L-1的盐酸完全中和,消耗盐酸的体积:①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径 | B. | 最外层电子数 | C. | 电子层数 | D. | 次外层电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某物质的水溶液PH<7,则该物质一定是酸或强酸弱碱盐 | |
| B. | pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 | |
| C. | 稀释醋酸溶液,溶液中所有离子的浓度均降低 | |
| D. | pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+)>c(CH3COO-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com