
| A. | 5.6 g Fe和足量的盐酸完全反应失去电子数为0.3 NA | |
| B. | 1mol.L-1 K2SO4溶液所含K+数目为2NA | |
| C. | 1 mol钠与氧气反应生成Na2O或Na2O2时,失电子数目均为N A | |
| D. | 常温常压下,2.24L CO 和CO2 混合气体中含有的碳原子数目为0.1NA |
分析 A、求出铁的物质的量,然后根据1mol铁在和盐酸反应时失去2mol电子来分析;
B.溶液体积不知不能计算微粒数;
C.钠为+1价金属,1mol钠完全反应失去1mol电子;
D.气体摩尔体积标准状况下为22.4L/mol;
解答 解:A、5.6g铁的物质的量为0.1mol,而铁和盐酸反应后变为+2价,故1mol铁在和盐酸反应时失去2mol电子,则0.1mol铁失去0.2mol电子,即0.2NA个,故A错误;
B.1mol.L-1 K2SO4溶液所含K+数浓度为1mol/L,溶液体积不知不能计算微粒数,故B错误;
C.1 mol钠与氧气反应生成Na2O或Na2O2时,生成产物中Na的化合价都是+1价,失去电子的物质的量都为1mol,失电子数目均为NA,故C正确;
D.常温常压下,2.24L CO 和CO2 混合气体物质的量不是0.1mol,故D错误;
故选C.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标准状况下气体摩尔体积的使用条件,试题培养了学生的计算能力及灵活应用能力.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氰分子中四原子共直线,是非极性分子 | |
| B. | 氰分子中C≡N键长大于C≡C键长 | |
| C. | 氰气分子中含有σ键和π键 | |
| D. | 氰化氢在一定条件下能与烯烃发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与稀硫酸反应 Fe+2H+═Fe3++H2↑ | |
| B. | 二氧化碳与水反应 CO2+H2O═2H++CO32- | |
| C. | 碳酸钡与盐酸反应 CO32-+2H+═H2O+CO2↑ | |
| D. | 氢氧化钠溶液与硫酸铜溶液反应2OH-+Cu2+═Cu(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 脱落酸具有催熟作用,可延长鲜花盛开时间,脱落酸的结构简式如图所示,下列说法不正确的是( )
脱落酸具有催熟作用,可延长鲜花盛开时间,脱落酸的结构简式如图所示,下列说法不正确的是( )| A. | 脱落酸在一定条件下能和乙酸发生酯化反应 | |
| B. | 脱落酸分子中含有4个甲基 | |
| C. | 等量脱落酸与足量的NaHCO3、Na反应,放出CO2与H2的物质的量之比为n(CO2):n(H2)=2:1 | |
| D. | 脱落酸能使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:Z>W>X>Y | |
| B. | W、X形成的化合物中一定含有离子键 | |
| C. | 最简单氢化物的还原性:Z>W | |
| D. | 工业上常用电解熔融氯化物的方法制备X、Y的单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
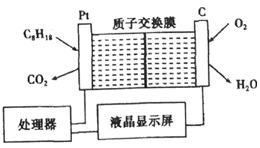 为了强化安全管理,某油库引进了一台空气中汽油含量的测量仪,其工作原理如图所示(用强酸性溶液作电解质溶液).下列说法中不正确的是( )
为了强化安全管理,某油库引进了一台空气中汽油含量的测量仪,其工作原理如图所示(用强酸性溶液作电解质溶液).下列说法中不正确的是( )| A. | 石墨电极作正极,发生还原反应 | |
| B. | 铂电极的电极反应式为:C8H18+16H2O-50e-═8CO2+50H+ | |
| C. | 每消耗标准状况下5.6 L O2溶液中通过lmol 电子 | |
| D. | H+由质子交换膜左侧向右侧迁移 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com