
| A.原子半径:丙<乙<甲 |
| B.若甲、乙、丙、丁的单质在常温下均为气态,则核电荷数比甲少1的元素形成的单质熔点可能很高。 |
| C.若甲、乙、丙均是金属,则氢氧化物碱性:甲<乙<丙 |
| D.若乙的最高价含氧酸为强酸,则丙是活泼非金属元素 |
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源:不详 题型:单选题
| A.元素周期表有七个横行,分为七个周期 |
| B.元素周期表有九个横行,分为七个周期 |
| C.元素周期表有十八个纵行,分为十六个族 |
| D.元素周期表有十八个纵行,分为十八个族 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
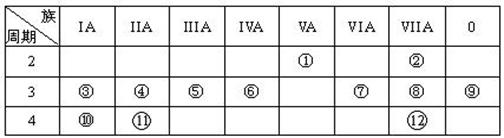
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①③④ | B.①③⑥ | C.③④⑤ | D.②④⑥ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.第二周期元素氢化物稳定性顺序是HF>H2O>NH3;则第三周期元素氢化物稳定性顺序也是HCl>H2S>PH3 |
| B.Fe3O4可写成FeO·Fe2O3;Pb3O4也可写成PbO·Pb2O3 |
| C.可电解熔融MgCl2来制取金属镁;也能电解熔融AlCl3来制取金属铝 |
| D.晶体中有阴离子,必有阳离子;则晶体中有阳离子,也必有阴离子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
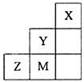
| A.氢化物的稳定性:Y<M |
| B.离子半径:M—>Z2— |
| C.ZM2分子中各原子的最外层均满足8电子稳定结构 |
| D.元素Z的最高价氧化物对应的水化物的酸性比M的强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.任何一个能层最多只有s、p、d、f四个能级 |
| B.用n表示能层序数,则每一能层最多容纳电子数为2n2 |
| C.核外电子的运动的概率分布图(电子云)就是原子轨道 |
| D.电子的运动状态可从能层、能级、轨道3个方面进行描述 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原子半径:N可能比Y大,也可能比Y小 |
| B.M2+、N2-核外电子数:可能相等,也可能不相等 |
| C.原子序数:N>M>X>Y |
| D.碱性:M(OH)2>YOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com