
甲醇可作为燃料电池的原料。通过下列反应可以制备甲醇:
 CO ( g ) + 2H2 ( g )
CO ( g ) + 2H2 ( g )  CH3OH ( g ) △H =-90.8 kJ·mol-1 在一容积可变的密闭容器中充入10 mol CO 和20 molH2,CO 的平衡转化率随温度(T)、压强(P)的变化如右图所示,当达到平衡状态A 时,容器的体积为20 L。
CH3OH ( g ) △H =-90.8 kJ·mol-1 在一容积可变的密闭容器中充入10 mol CO 和20 molH2,CO 的平衡转化率随温度(T)、压强(P)的变化如右图所示,当达到平衡状态A 时,容器的体积为20 L。
(1)该反应的化学平衡常数表达式为 ▲ 。
(2)如反应开始时仍充入10mol CO 和20mol H2,则在平衡状态B时容器的体积V(B)= ▲ L。
(3)关于反应CO(g)+2H2(g) CH3OH(g)在化学平衡状态时的描述正确的是 ▲ (填字母)。
CH3OH(g)在化学平衡状态时的描述正确的是 ▲ (填字母)。
A.CO的含量保持不变 B.容器中CH3OH浓度与CO浓度相等
C.2V正(CH3OH)=V正(H2)D.容器中混合气体的平均相对分子质量保持不变
(4)CO(g)+2H2(g) CH3OH(g),按照相同的物质的量
CH3OH(g),按照相同的物质的量
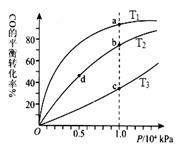 投料,测得CO在不同温度下的平衡转化率与压强的
投料,测得CO在不同温度下的平衡转化率与压强的
关系如右图所示。下列说法正确的是 ▲
A.温度:T1 < T2 <T3
B.正反应速率:ν(a)>ν(c); ν(b)>ν(d)
C.平衡常数: K(a) =K(c) ; K(b) >K(d)
D.平均摩尔质量:M(a)<M(c); M(b)>M(d)
(5)已知CO2(g)+H2(g) CO(g)+H2O(g) △H= + 41.3 kJ·mol-1 ,试写出由
CO(g)+H2O(g) △H= + 41.3 kJ·mol-1 ,试写出由
CO2和H2制取甲醇的热化学方程式 ▲ 。
 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:
某已知A、B均是由两种短周期元素组成的化合物,A中某元素的质量分数为25%,B的焰色反应呈黄色,C、J、X是同周期的元素的简单氢化物,X为无色液体,C、J为气体,D是一种不溶于水的白色固体。反应生成的水均已略去。它们有如下图所示的关系。
(1)写出化学式:A_________,E____________,L___________
(2)在反应①②③④⑤中属于氧化还原反应的是_____________________________
(3)反应③化学方程式为:_______________________________________________
(4)写出下列离子方程式:反应②_________________________________________;
G溶液与M溶液的反应______________________________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验现象与氧化还原反应有关的是( )
A.铁和铝在浓硫酸和浓硝酸中发生钝化
B.向硅酸钠溶液中滴加适量的稀盐酸,有透明的凝胶形成
C.NO2 通入水中,气体由红棕色逐渐转变为无色
D.硫酸铁溶液中滴加硫氰化钾溶液变红
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙之间有如下图所示的转化关系,其中甲物质为氧化物:

⑴ 若甲是不溶于水的白色固体,但既能溶于硫酸又能溶于氢氧化钠溶液,则甲的一种重要的工业用途是___________________________;
写出下列转化的方程式:
乙 丙的离子方程式_____________________________;
丙的离子方程式_____________________________;
丙 甲的化学方程式______________________________。
甲的化学方程式______________________________。
⑵若甲是不溶于水的黑色固体,且向乙溶液中加入KSCN溶液,混合溶液呈红色,
则甲物质的俗称是_______。
甲 乙的离子方程式是__________________________。
乙的离子方程式是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知一定条件下A、B、C、D之间的转化关系如右图所示。下列说法正确的是( )
 A.若A为Fe,D为氢气,则B一定为酸
A.若A为Fe,D为氢气,则B一定为酸
B.若A、D为化合物,B为水,则C一定是气体单质
C.若A、B、C、D均为化合物,该反应一定属于复分解反应
D.若A、B、C、D均为10电子微粒,且C是可使湿润的红色石蕊试纸变蓝的气体,则D常温下一定呈液态
查看答案和解析>>
科目:高中化学 来源: 题型:
几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径(×10-10 m) | 1.86 | 0.99 | 1.43 | 1.60 | 0.75 | 0.74 | |
| 主要化合价 | 最高正价 | +1 | +7 | +3 | +2 | +5 | —— |
| 最低负价 | —— | 1 | —— | ——- | -3 | -2 |
已知,X、Y、Z和M下列说法正确的是
A.X、Z、R的最高价氧化物的水化物之间可两两相互反应
B.元素X和Q形成的化合物中不可能含有共价键
C.X、Z、M的单质分别与水反应,Y最剧烈
D.Y的氢化物的水溶液可用于雕刻玻璃
查看答案和解析>>
科目:高中化学 来源: 题型:
氯气常用于自来水厂杀菌消毒。
(1)工业上用铁电极和石墨做为电极电解饱和食盐水生产氯气,铁电极作 极,石墨电极上的电极反应式为 。
(2)氯氧化法是在碱性条件下,用Cl2将废水中的CN-氧化成无毒的N2和CO2。该反应的离子方程式为 。
(3)氯胺(NH2Cl)消毒法是在用液氯处理自来水的同时通入少量氨气,发生反应:Cl2 + NH3 === NH2Cl + HCl,生成的NH2Cl比HClO稳定,且能部分水解重新生成HClO,起到消毒杀菌的作用。
①氯胺能消毒杀菌的原因是 (用化学用语表示)。
②氯胺消毒法处理后的水中,氮元素多以NH4+的形式存在。
已知:NH4+(aq) + 1.5O2(g)=== NO2-(aq) + 2H+(aq) + H2O (l) ΔH=-273 kJ·mol-1
NH4+(aq) + 2O2(g)=== NO3-(aq) + 2H+(aq) + H2O (l) ΔH =-346 kJ·mol-1
NO2-(aq)被O2氧化成NO3-(aq)的热化学方程式为 。
(4)在水产养殖中,可以用Na2S2O3将水中残余的微量Cl2除去,某实验小组利用下图所示装置和药品制备Na2S2O3。

|
结合上述资料回答:
① 开始通SO2时,在B口检测到有新的气体生成,判断从B口排出的气体中是否含有H2S,并写出判断依据 。
② 为获得较多的Na2S2O3,当溶液的pH接近7时,应立即停止通入SO2,其原因 是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值。下列叙述正确的是
A.1 L 1.0 mol/L的NH4Al(SO4)2溶液中含有的氧原子数为8NA
B.25℃时pH=13的NaOH溶液中含有OH-的数目为0.1NA
C.标准状况下,2.24 L CO和CO2混合气体中含有的碳原子数目为0.1NA
D.1 mol FeCl3完全水解得到的Fe(OH)3胶体中含有的胶粒的数目为1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
甲烷分子是以碳原子为中心的正四面体形结构,而不是正方形的平面结构,以下事实可作为论据的是
A.CH3Cl只有一种结构 B.CH2Cl2只有一种结构
C.CHCl3只有一种结构 D.CH4只有一种结构
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com