
科目:高中化学 来源: 题型:选择题
| A. | 透明溶液中:K+、Cu2+、SO42-、Cl- | |
| B. | KI水溶液中:K+、NO3-、SO42-、H+ | |
| C. | 使紫色石蕊试液变蓝色的溶液:K+、Na+、HS-、Cl- | |
| D. | 水电离出的c(H+)=1×10-14mol•L-1的溶液:K+、NH4+、AlO2-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 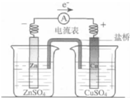 图中总反应为Zn+CuSO4═Cu+ZnSO4 | |
| B. | 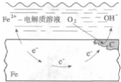 图中正极反应为2H2O+O 2+4e-═4OH- | |
| C. |  图中负极反应为Zn+2OH--2e-═Zn(OH)2 | |
| D. |  图中向Fe电极区滴入2滴铁氰化钾溶液产生蓝色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | C-C | O=O | C=O |
| 键能(kJ/mol) | 348 | 498 | x |
| A. | x=794.5 | |
| B. | x=1142.5 | |
| C. | 1mol金刚石的能量一定比1mol CO2能量高 | |
| D. | 金刚石燃烧的热化学方程式为 2C(s)+O2(g)=2CO(g)△H=-790 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
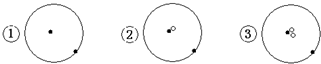
 表示质子或电子,
表示质子或电子, 表示中子,则下列有关的叙述正确的是( )
表示中子,则下列有关的叙述正确的是( )| A. | ①②③是三种化学性质不同的粒子 | B. | ①②③具有相同的质量数 | ||
| C. | ①②③为同素异形体 | D. | ①②③互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH和CH3COONH4都是弱电解质 | |
| B. | Na2O2既含离子键又含共价键 | |
| C. | HBr、HCl、HF的酸性依次增强 | |
| D. | 二氧化硅有导电性,可用于制备光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
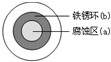 铁及其化合物在国民经济的发展中起着重要作用.
铁及其化合物在国民经济的发展中起着重要作用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mo1 Na2O2所含的阴离子 | |
| B. | 1 L0.1 mol•L-1氨水中的NH${\;}_{4}^{+}$ | |
| C. | 12.5mL 16 mo1•L-1的浓硫酸能溶解的Cu | |
| D. | 4.6g N02气体所含的分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com