
贝诺酯是由阿斯匹林、扑热息痛经化学拼合制备的解热镇痛抗炎药,其合成反应式(反应条件略去)如下:
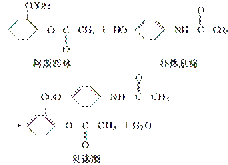
下列叙述错误的是( )
A.FeCl3溶液可区别阿斯匹林和扑热息痛
B.1 mol阿斯匹林最多可消耗2 mol NaOH
C.常温下贝诺酯在水中的溶解度小于扑热息痛
D.C6H7NO是扑热息痛发生类似酯水解反应的产物
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
橙花醇具有玫瑰及苹果香气,可作为香料,其结构简式如下:
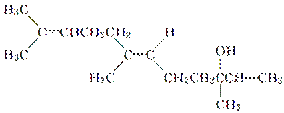
下列关于橙花醇的叙述,错误的是( )
A.既能发生取代反应,也能发生加成反应
B.在浓硫酸催化下加热脱水,可以生成不止一种四烯烃
C.1 mol橙花醇在氧气中充分燃烧,需消耗470.4 L氧气(标准状况)
D.1 mol橙花醇在室温下与溴的四氯化碳溶液反应,最多消耗240 g溴
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D均为含苯环的化合物,且相对分子质量B>A>C,已知有机物A的结构简式为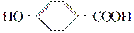 。
。
(1)A既能和NaOH溶液反应,又能和NaHCO3溶液反应,写出A和NaHCO3溶液反应的化学方程式___________________________________。
(2)有机物B在浓H2SO4存在条件下,相互作用生成一种环状酯(如下图)则有机物B的结构简式为____________。等物质的量B与Na、NaOH、NaHCO3充分反应,消耗Na、NaOH、NaHCO3的物质的量之比为________。
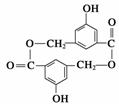
(3)D和B互为同分异构体,且知苯环上的一氯代物只有两种,D不与NaHCO3反应,能与Na和NaOH反应,等质量的D消耗Na和NaOH的物质的量比为2∶3,则D的结构简式为________________。(只写一种即可)
(4)1 mol A、C完全燃烧,消耗O2的质量相等,且1 mol C能和1 mol Na完全反应,写出含碳原子数最少的C的结构简式__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.乙烯和乙烷都能发生加聚反应
B.蛋白质水解的最终产物是多肽
C.米酒变酸的过程涉及了氧化反应
D.石油裂解和油脂皂化都是由高分子生成小分子的过程
查看答案和解析>>
科目:高中化学 来源: 题型:
对二甲苯(英文名称pxylene,缩写为PX)是化学工业的重要原料。
(1)写出PX的结构简式:______________。
(2)PX可发生的反应有________、________(填反应类型)。
(3)增塑剂(DEHP)存在如下图所示的转化关系,其中A是PX的一种同分异构体。
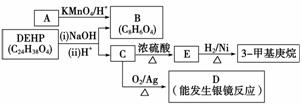
①B的苯环上存在2种不同化学环境的氢原子,则B的结构简式是__________________。
②D分子所含官能团是____________(填名称)。
③C分子有1个碳原子连接乙基和正丁基,DEHP的结构简式是__________________。
(4)F是B的一种同分异构体,具有如下特征:
a.是苯的邻位二取代物;
b.遇FeCl3溶液显示特征颜色;
c.能与碳酸氢钠溶液反应。
写出F与NaHCO3溶液反应的化学方程式:________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,对于 ① 0.1 mol/L CH3COOH溶液 ② pH = 1 HCl溶液 ③ pH =13的NaOH溶液④ 0.1 mol/L CH3COONa溶液,下列说法正确的是( )
A.①和②分别稀释100倍后的pH: ② > ①
B.水电离出的c(OH-):④>③> ① > ②
C.①和③混合后溶液呈中性:c(Na+) /c(CH3COO-) < 1
D.①和④混合后溶液呈酸性:c(Na+) / c(CH3COO-)>1
查看答案和解析>>
科目:高中化学 来源: 题型:
为探讨化学平衡移动原理与氧化还原反应规律的联系,某同学通过改变浓度研究“2Fe3++2I- 2Fe2++I2”反应中Fe3+和Fe2+的相互转化。实验如下:
2Fe2++I2”反应中Fe3+和Fe2+的相互转化。实验如下:
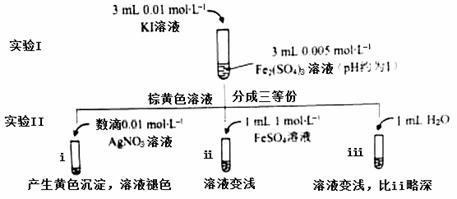
(1)待实验I溶液颜色不再改变时,再进行实验II,目的是使实验I的反应达到 。
(2)iii是ii的对比试验,目的是排除有ii中 造成的影响。
(3)i和ii的颜色变化表明平衡逆向移动,Fe2+向Fe3+转化。用化学平衡移动原理解释原因: 。
(4)根据氧化还原反应的规律,该同学推测i中Fe2+向Fe3+转化的原因:外加Ag+使c(I-)降低,导致I-的还原性弱于Fe2+,用右图装置(a、b均为石墨电极)进行实验验证。

①K闭合时,指针向右偏转,b作 极。
②当指针归零(反应达到平衡)后,向U型管左管滴加0.01 mol/L AgNO3溶液,产生的现象证实了其推测,该现象是 。
(5)按照(4)的原理,该同学用上图装置进行实验,证实了ii中Fe2+向Fe3+转化的原因,
①转化原因是 。
②与(4)实验对比,不同的操作是 。
(6)实验I中,还原性:I->Fe2+;而实验II中,还原性:Fe2+>I-,将(3)和(4)、(5)作对比,得出的结论是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有机物的命名肯定错误的是 ------------------------------------------( )
A. 3-甲基-2-戊烯 B.2-甲基-2-丁烯 C. 2,2-二甲基丙烷 D. 2-甲基-3-丁炔
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com