
| A、①②③ | B、②③④ |
| C、①②③④ | D、①③④ |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
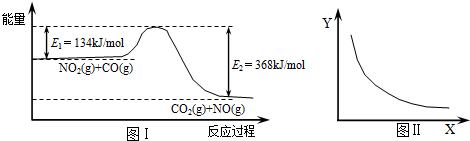
| A、该反应的焓变△H=+234 kJ?mol-1 |
| B、若X表示体系的压强,则Y表示的可能是NO2的转化率 |
| C、若X表示温度则Y表示的可能是CO2物质的量浓度 |
| D、增大CO的起始浓度,平衡向正反应方向移动,反应热增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| A、②中所含官能团种类比③中多 |
| B、①、④互为同系物 |
| C、①、②、③、④均能与氢氧化钠溶液反应 |
| D、等物质的量②、③分别在足量氧气中完全燃烧,前者消耗氧气比后者少 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 溶解 |
| 沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
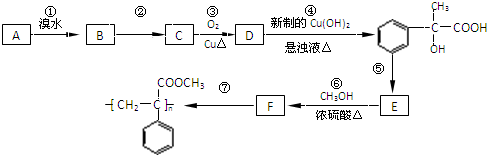
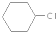 为原料合成重要的化工产品
为原料合成重要的化工产品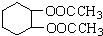 .合成路线流程图示例如下:
.合成路线流程图示例如下: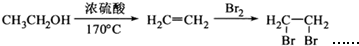 .
.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应过程中,若增大压强能提高SiCl4的转化率 |
| B、若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ |
| C、当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol/L的NaOH溶液恰好反应 |
| D、反应至4 min时,若HCl浓度为0.12 mol/L,则H2的反应速率为0.03 mol/(L?min) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com