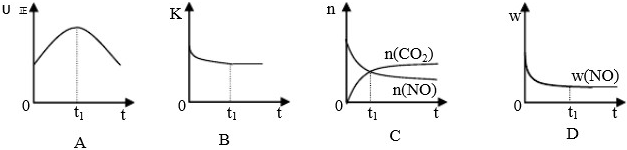
(2013?闵行区二模)研究NO
2、SO
2、CO等大气污染气体的处理具有重要意义.
I.利用反应:6NO
2+8NH
37N
2+12H
2O处理NO
2.
II.一定条件下NO
2与SO
2可发生反应,方程式:NO
2(g)+SO
2(g)?SO
3(g)+NO(g)-Q.
III.CO可用于合成甲醇,反应方程式为:CO(g)+2H
2(g)?CH
3OH(g).
(1)对于I中的反应,120℃时,该反应在一容积为2L的容器内反应,20min时达到平衡,10min时电子转移了1.2mol,则0~10min时,平均反应速率υ(NO
2)=
0.015mol/(L?min)
0.015mol/(L?min)
.
(2)对于II中的反应,将NO
2与SO
2以体积比1:2置于密闭容器中反应,下列能说明反应达到平衡状态的是
bc
bc
(选填编号).
a.体系压强保持不变 b.混合气体颜色保持不变
c.NO
2和SO
3的体积比保持不变 d.混合气体的平均相对分子质量保持不变
(3)如果Ⅱ中反应的平衡常数K值变大,该反应
a
a
(选填编号).
a.一定向正反应方向移动 b.平衡移动时,正反应速率先减小后增大
c.一定向逆反应方向移动 d.平衡移动时,逆反应速率先增大后减小
(4)对于Ⅲ中的反应,CO在不同温度下的平衡转化率与压强的关系如图示.该反应是
放热
放热
反应(填“放热”或“吸热”).实际生产条件控制在250℃、1.3×10
4kPa左右,简述选择此压强的理由:
在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,得不偿失.
在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,得不偿失.
.

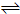 2NH3(正反应为放热反应)下列叙述中正确的是( )
2NH3(正反应为放热反应)下列叙述中正确的是( )

 (2013?闵行区二模)研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
(2013?闵行区二模)研究NO2、SO2、CO等大气污染气体的处理具有重要意义.