
| A. | 5.6g、0.1mol | B. | 4.6g、0.2mol | C. | 0.3g、0.2mol | D. | 5.0g、0.4mol |
分析 求出过氧化钠的物质的量,然后根据过氧化钠与足量的水蒸气和二氧化碳的混合气体接触并完全反应的情况来分类讨论:
(1)若过氧化钠全部和水反应,根据反应可知:2Na2O2+2H2O=4NaOH+O2↑,此反应实际增重的质量是氢气的质量,且2molNa2O2~增重2mol氢气~2mol电子,据此分析;
(2)若过氧化钠全部和水反应,根据反应可知:2Na2O2+2CO2=2Na2CO3+O2↑,此反应实际增重的质量是CO的质量,且2molNa2O2~增重2molCO~2mol电子,据此分析;
通过讨论,得出两个极限值,然后取中间值即可.
解答 解:15.6g过氧化钠的物质的量为0.2mol,而过氧化钠与足量的水蒸气和二氧化碳的混合气体接触并完全反应有两种极限可能:
(1)若过氧化钠全部和水反应,根据反应可知:2Na2O2+2H2O=4NaOH+O2↑,此反应实际增重的质量是氢气的质量,且2molNa2O2~增重2mol氢气~2mol电子,故0.2mol过氧化钠能增重0.2mol氢气的质量即0.4g,转移0.2mol电子;
(2)若过氧化钠全部和水反应,根据反应可知:2Na2O2+2CO2=2Na2CO3+O2↑,此反应实际增重的质量是CO的质量,且2molNa2O2~增重2molCO~2mol电子,故0.2mol过氧化钠能增重0.2molCO的质量即5.6g,并转移0.2mol电子;
而0.2mol过氧化钠实际是和水蒸气、二氧化碳的混合气体反应,故转移的电子一定为0.2mol,而增重在0.4g到5.6g之间,故选B.
点评 本题考了过氧化钠和水、二氧化碳的范围讨论题,综合性较强,应注意的是过氧化钠和水、二氧化碳反应时,增重的分别是氢气和CO的质量,且转移的电子数相同.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| A | B | ||||||
| D | E | F | |||||
| C | G | H |
 ;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).
;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在阴离子中,质子数一定少于核外电子数 | |
| B. | 氧化反应就是物质与氧气发生的反应 | |
| C. | 在化学反应中加入催化剂一定能加快反应的速率 | |
| D. | 最外层电子数为8的粒子一定是稀有气体元素的原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4(HCl):AgNO3溶液、过滤 | B. | KNO3(K2SO4):Ba(NO3)2溶液、过滤 | ||
| C. | Cu(CuO):盐酸、过滤 | D. | CaCO3(CaO):水、过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合粉末中物质的量之间一定满足:n(Cu)+n(Fe)=n(Fe2O3) | |
| B. | 混合粉末中物质的量之间一定满足:n(Fe)>n(Cu)>n(Fe2O3) | |
| C. | 混合粉末中物质的量之间一定满足:n(Cu)+n(Fe)═n(Fe2O3)+$\frac{bL}{22.4L•mo{l}^{-1}}$ | |
| D. | 若a=72.50,b=1.12,则20.40g混合粉末中:n(Fe)=n(Cu)=0.05mol、n(Fe2O3)=0.09mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
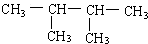 系统命名:2,3-二甲基丁烷
系统命名:2,3-二甲基丁烷
 的分子式:C4H8O
的分子式:C4H8O查看答案和解析>>
科目:高中化学 来源: 题型:解答题
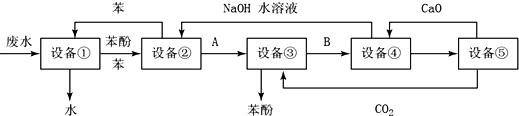
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com