
【题目】(1) A元素的原子最外层电子数是次外层电子数的2倍,则该元素的原子核内质子数____。
(2)已知铁(Fe)原子的核内质子数为26,核外共有4个电子层,最外电子层上的电子数是2,写出铁原子的结构示意图:_____。
(3) a元素原子M电子层上有6个电子,b元素与a元素的原子核外电子层数相同,b元素的原子最外层电子数为1。a、b两种元素形成的化合物名称是______。该化合物在无色火焰上燃烧时,火焰呈____色。
科目:高中化学 来源: 题型:
【题目】在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图,下列表述中正确的是( )
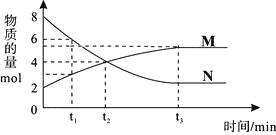
A. 反应的化学方程式为:2M![]() N
N
B. t2时,正逆反应速率相等,达到平衡
C. t3时,正反应速率大于逆反应速率
D. t1时,N的浓度是M浓度的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食盐是日常生活的必需品,也是重要的化工原料。粗食盐常含有少量CaCl2、MgCl2、Na2SO4等杂质,实验室提供的试剂如下:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液。实验室提纯NaCl的流程如图:

(1)欲除去溶液I中的杂质,写出A所代表的多种试剂,按滴加顺序依次为I.NaOH;Ⅱ.___________;Ⅲ.____________ (填化学式)。
(2)请写出下列试剂加入时发生反应的化学方程式:
①加入试剂I: ____________________________。
②加入盐酸:______________________________________________________.
(3)操作a、b中均用到的玻璃仪器是________、_______(填仪器名称),操作c的名称为___________________。
(4)如何对操作b所得到的沉淀进行洗涤:________________________。
(5)经过操作b后,如何检验所得溶液中的SO42-已除去:______________。
(6)若上述流程中未进行操作b,即直接向溶液I中加盐酸到pH为45,过滤,得到沉淀X和溶液Y,则沉淀X为__________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将固体NH4HS置于密闭容器中,在某温度下发生下列反应:NH4HS(s)NH3(g)+H2S(g), H2S(g)H2(g)+S(g)。当反应达到平衡时C(H2)=0.5 mol/L,C(H2S)=4.0 mol/L,则第一步的平衡常数为
A. 16 (mol/L)2 B. 18 (mol/L)2
C. 20.25 (mol/L)2 D. 22 (mol/L)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下的aLHCl(g)溶于1000g水中,得到的盐酸密度为bg·cm-3,则该盐酸的物质的量浓度是( )
A. ![]() mol·L-1B.
mol·L-1B. ![]() mol·L-1
mol·L-1
C. ![]() mol·L-1D.
mol·L-1D. ![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、铜混合粉末18.0g加入到100mL 5.0mol·L-1FeCl3溶液中,充分反应后,剩余固体质量为2.8g。已知先发生反应2FeCl3+Fe=3FeCl2、后发生 2FeCl3+Cu=2FeCl2+CuCl2。求:
(1)原固体混合物中铜的质量是___________g。
(2)反应后溶液中n(Fe2+)+ n(Cu2+)___________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2的转化一直是全球研究的热点,其中将CO2和H2合成甲醇及甲醚(CH3OCH3)具备相对成熟的技术。工业生产中,有以下相关反应(热效应都是在25℃,1.01×105Pa下测定):
①CO2(g) + 3H2(g) CH3OH(l) + H2O(l) △H1 = -49.01KJ/mol
②2 CH3OH(l) CH3OCH3(g) + H2O(l) △H2 = -24.52KJ/mol
③CO(g) + H2O(l) CO2(g) + H2(g) △H3 = -41.17KJ/mol
(1)工业上用CO2和H2合成二甲醚的热化学方程式为________________。
(2)反应②的平衡常数表达式K=__________________,在一定条件下反应②达到平衡状态,CH3OCH3的浓度为c1,若此时体积压缩为原来的一半,再次平衡时的浓度c2,则c2__________c1(填“>”、“<”或“=”)
(3)在一常温恒容的密闭容器中,放入一定量的甲醇如②式建立平衡,以下说发正确并可以作为该反应达到平衡状态的判断依据为________。
A.容器内气体相对分子质量保持不变;
B.容器内气体压强不变;
C.相同时间内消耗甲醇的量是消耗二甲醚的两倍;
D.甲醇和二甲醚物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,在容积不变的密闭容器内进行反应:2NO+2CO![]() N2+2CO2 △H<0.曲线a表示NO的转化率与反应时间的关系,若改变初始条件,使反应过程按照曲线b进行,可采取的措施是
N2+2CO2 △H<0.曲线a表示NO的转化率与反应时间的关系,若改变初始条件,使反应过程按照曲线b进行,可采取的措施是

A. 加催化剂 B. 降低温度
C. 增大NO的浓度 D. 缩小容器体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(其密度为1.84g/cm3)配制100mL1.0mol·L-1稀硫酸,若实验仪器有:
A.100mL量筒 B.托盘天平 C.玻璃棒 D.50mL容量瓶 E.10mL量筒 F.胶头滴管 G.50mL烧杯 H.100mL容量瓶
(1)需量取浓硫酸的体积为_______mL。
(2)实验时选用的仪器有(填序号)_______。
(3)配制过程中,下列情况会使配制结果偏高的是________(填序号) 。
①定容时俯视刻度线观察液面
②容量瓶使用时未干燥
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
(4)在容量瓶使用方法中,下列操作不正确的是(填序号)_______。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配液润洗
C.将氢氧化钠固体放在天平托盘的滤纸上,准确称量并放入烧杯中溶解后,立即注入容量瓶中
D.将准确量取的18.4mol·L-1的硫酸,注入已盛有30mL水的100mL的容量瓶中,加水至刻度线
E.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com