
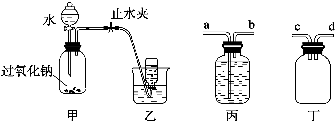
分析 (1)先夹紧止水夹,在分液漏斗中加入水,打开分液漏斗的活塞,根据水流速度变化判断气密性;
(2)过氧化钠与水反应生成氢氧化钠和氧气,检查写出反应的化学方程式;
(3)装置丙无法防止倒吸,应该选用装置丁;导管c、d都可以连接装置甲的出气口;
(4)双氧水不稳定,在二氧化锰作催化剂条件下能够分解生成氧气,据此可设计实验证明广口瓶内的溶液中含有H2O2;向滴有酚酞的氢氧化钠溶液中加入双氧水,若红色褪去可证明该结论.
解答 解:(1)检查装置甲气密性是否良好的方法为:夹紧止水夹,在分液漏斗中加入水,打开分液漏斗的活塞,若漏斗中水下流速度越来越小,最后停止,说明气密性良好,
故答案为:夹紧止水夹,在分液漏斗中加入水,若漏斗中水下流速度越来越小,最后停止,说明气密性良好;
(2)过氧化钠与水反应生成氢氧化钠和氧气,反应的化学方程式为:2Na2O2+2H2O=4NaOH+O2↑,
故答案为:2Na2O2+2H2O=4NaOH+O2↑;
(3)装置丙没有防止倒吸的功能,应该选用装置丁,当发生倒吸时水进入装置丁,从而避免了大量水进入装置甲;与装置甲的出气口相连的可以是c或d,
故答案为:丁;c(或d);
(4)证明广口瓶内的溶液中含有H2O2的方法为:取广口瓶中的溶液置于试管中,加入少量MnO2,若有气泡放出,用带火星的木条检验,木条复燃,则说明溶液中有H2O2,
证明H2O2溶液能够使滴有酚酞的稀NaOH溶液的红色迅速褪去的方法为:在试管中加入滴加酚酞试液的稀NaOH溶液1 mL,然后再向试管中滴加1 mL H2O2溶液,若“红色迅速褪去”,则证明H2O2溶液能够使滴有酚酞试液的稀NaOH溶液“红色迅速褪去”,
故答案为:取广口瓶中的溶液置于试管中,加入少量MnO2,若有气泡放出,用带火星的木条检验,木条复燃,则说明溶液中有H2O2;在试管中加入滴加酚酞试液的稀NaOH溶液1 mL,然后再向试管中滴加1 mL H2O2溶液,若“红色迅速褪去”,则证明H2O2溶液能够使滴有酚酞试液的稀NaOH溶液“红色迅速褪去”.
点评 本题考查了性质实验方案的设计与评价,题目难度中等,明确实验目的及实验原理为解答关键,注意掌握过氧化钠与水反应的实质、性质实验方案设计的原则,试题培养了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:解答题
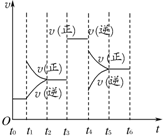 在一密闭容器中发生下列反应:2SO2(g)+O2(g)?2SO3(g)△H<0,如图所示是某一时间段中反应速率与反应进程的曲线关系.回答下列问题:
在一密闭容器中发生下列反应:2SO2(g)+O2(g)?2SO3(g)△H<0,如图所示是某一时间段中反应速率与反应进程的曲线关系.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、AlO2-、Cl- | B. | Ba2+、Na+、Al3+、SO42- | ||
| C. | K+、Mg2+、Cl-、NO3- | D. | Na+、Ca2+、Cl-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所用NaOH已经潮解 | |
| B. | 向容量瓶中加水定容时俯视标线 | |
| C. | 用量筒量取所需的浓盐酸时俯视刻度线 | |
| D. | 定容后倒转容量瓶几次,发现液面最低点低于标线,再补几滴水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
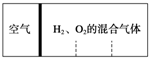 如图所示,分别向密闭容器内可移动活塞的两边充入空气(已知空气体积占整个容器容积的$\frac{1}{4}$)、H2和O2的混合气体,在标准状况下,若将H2、O2的混合气体点燃引爆.活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央.则原来H2、O2的体积之比可能为7:2 或4:5.
如图所示,分别向密闭容器内可移动活塞的两边充入空气(已知空气体积占整个容器容积的$\frac{1}{4}$)、H2和O2的混合气体,在标准状况下,若将H2、O2的混合气体点燃引爆.活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央.则原来H2、O2的体积之比可能为7:2 或4:5.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2 | B. | N2 | C. | NH3 | D. | SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,28g CO和N2的混合气体中含有的分子总数为NA | |
| B. | 1 mol铁与足量盐酸完全反应时失去的电子数为3NA | |
| C. | 78g过氧化钠晶体中,含2NA个阴离子 | |
| D. | 标准状况下,22.4 LH2S和SO2的混合气体中含有的分子总数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将少量金属钠放入冷水中:Na+2H2O=Na++2OH-+H2↑ | |
| B. | 将铝片加入盐酸溶液中:2Al+6H+=2Al3++3H2↑ | |
| C. | 向碳酸钠溶液中加入CH3COOH:CO${\;}_{3}^{2-}$+2H+=CO2↑+H2O | |
| D. | 向澄清石灰水中通入过量的二氧化碳:Ca2++2OH-=CaCO3↓+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com