
已知2SO2(g)+O2(g) 2SO3(g) ΔH=-197 kJ·mol-1,向同温、同体积的三个密闭容器中分别充入气体:(甲)2 mol SO2和1 mol O2;(乙)
2SO3(g) ΔH=-197 kJ·mol-1,向同温、同体积的三个密闭容器中分别充入气体:(甲)2 mol SO2和1 mol O2;(乙)
1 mol SO2和0.5 mol O2;(丙)2 mol SO3。恒温、恒容下反应达平衡时,下列关系一定正确的是( )
A.容器内压强p:p甲=p丙>2p乙
B.SO3的质量m:m甲=m丙>2m乙
C.c(SO2)与c(O2)之比k:k甲=k丙>k乙
D.反应放出或吸收热量的数值Q:Q甲=Q丙>2Q乙
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
下列说法正确的是( )
A.热化学方程式中,如果没有注明温度和压强,则表示反应热是在标准状况下测得的
B.升高温度或加入催化剂,可以改变化学反应的反应热
C.据能量守恒定律,反应物的总能量一定等于生成物的总能量
D.物质发生化学变化一定伴随着能量变化
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏伽德罗常数,下列说法正确的是( )
A.0.2 mol H2O2完全分解转移的电子数为0.4NA
B.含NA个Na+的Na2O溶于1L水中,Na+的物质的量浓度为1mol·L-1
C.在标准状况下,2.8g N2和2.24LCO所含电子数均为1.4NA
D. 2.24L SO2与O2混合气体中所含氧原子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述错误的是( )
A.某溶液中加入Ba( NO3)2溶液和稀盐酸(过量)析出白色沉淀,则溶液中一定含SO42一.
B.硫酸加入漂白粉中能生成氯气,可用排饱和食盐水法收集
C.NaOH溶液不能保存在带胶头滴管的试剂瓶中,因为NaOH与磨口处的SiO2反应生成Na2SiO3形成粘结
D.可用热的饱和碳酸钠溶液除去金属表面的植物油
查看答案和解析>>
科目:高中化学 来源: 题型:
1 g氢气在氧气中完全燃烧生成气态水,放出热量120.9 kJ,则( )
A.1 mol H2和0.5 mol O2断键吸收的能量大于1 mol H2O(g)断键吸收的能量
B.氢气的燃烧热为241.8 kJ·mol-1
C.1 mol H2O(l)的能量大于1 mol H2O(g)的能量
D.2 mol H2和1 mol O2的能量总和大于2 mol H2O(g)的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素W、X、Y、Z中,W、Z同主族,X、Y、Z同周期,W的气态氢化物的稳定性大于Z的气态氢化物的稳定性,X、Y为金属元素,X2+的氧化性小于Y3+的氧化性。下列说法正确的是( )
A.X、Y、Z、W的原子半径依次增大
B.W与Z一定具有相同的最高正化合价
C.W的最高价氧化物的水化物一定是强酸
D.以X、Y、硫酸铜溶液组成的原电池中,Y作正极
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z均为短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z-,Y+和Z-具有相同的电子层结构。下列说法正确的是( )
A.原子最外层电子数:X>Y>Z
B.单质沸点:X>Y>Z
C.离子半径:X2->Y+>Z-
D.原子序数:X>Y>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,其相关信息如下表:
| 元素 | 相 关 信 息 |
| X | X的最高价氧化物对应的水化物化学式为H2XO3 |
| Y | Y是地壳中含量最高的元素 |
| Z | Z的基态原子最外层电子排布式为3s23p1 |
| W | W的一种核素的质量数为28,中子数为14 |
(1)W位于元素周期表第 周期第 族;W的原子半径比X的 (填“大”或“小”)。
(2)Z的第一电离能比W的 (填“大”或“小”); XY2由固态变为气态所需克服的微粒间作用力是 ;氢元素、X、Y的原子可共同形成多种分子,写出其中一种能形成同种分子间氢键的物质名称 。
(3)振荡下,向Z单质与盐酸反应后的无色溶液中滴加NaOH溶液直至过量,能观察到的现象是
;W的单质与氢氟酸反应生 成两种无色气体,该反应的化学方程式是 。
成两种无色气体,该反应的化学方程式是 。
(4)在25℃、101Kpa下,已知13.5g的Z固体单质在Y2气体中完全燃烧后恢复至原状态,放热419KJ,该反应的热化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
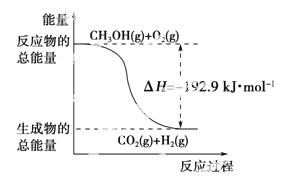
已知:①CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+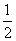 O
O 2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
下列说法正确的是 ( )。
A.CH3OH转变成H2的过程一定要吸收能量
B.①反应中,反应物的总能量高于生成物总能量
C.根据②推知反应:CH3OH(l)+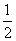 O2(g)===CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1
O2(g)===CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1
D.反应②中的能量变化如下图所示
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com