
| A. | K 1s22s22p63s23p64s1 | B. | Mg2+ 1s22s22p6 | ||
| C. | F- 1s22s22p5 | D. | Br 1s22s22p63s23p63d104s24p5 |
分析 根据微粒中存在的电子数,再根据构造原理书写核外电子排布式,简单阳离子中核外电子数=质子数-电荷数,简单阴离子中核外电子数=质子数+电荷数.
解答 解:A.K原子核外有19个电子,根据构造原理知,其核外电子排布式为1s22s22p63s23p64s1,故A正确;
B.镁离子核外有10个电子,根据构造原理知,其核外电子排布式为1s22s22p6,故B正确;
C.氟离子核外有10个电子,根据构造原理知,其核外电子排布式为1s22s22p6,故C错误;
D.溴原子核外有35个电子,根据构造原理知,其核外电子排布式为1s22s22p63s23p63d104s24p5,故D正确;
故选C.
点评 本题考查了原子核外电子排布式的书写,明确书写规则是解本题关键,知道简单阴阳离子中核外电子数的计算方法,题目难度不大.


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案科目:高中化学 来源: 题型:解答题
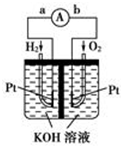 氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 反应是放热还是吸热,必须看反应物和生成物所具有的总能量的相对大小 | |
| C. | 放热反应在常温下一定很容易发生 | |
| D. | 化学反应一定有新物质的生成,但不一定有能量的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第二周期元素从左到右,最高正价从+1递增到+7 | |
| B. | ⅠA和ⅦA族元素间可形成离子化合物和共价化合物 | |
| C. | 同主族元素的简单阴离子还原性越强,元素非金属性越强 | |
| D. | 同周期金属元素的化合价越高,其金属性越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
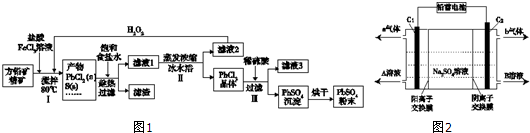
| Ksp | 开始沉淀时pH | 完全沉淀时pH | ||
| PbSO4 | 1.08×10-8 | Fe (OH)3 | 2.7 | 3.7 |
| PbCl2 | 1.6×10-5 | Pb( OH)2 | 6 | 7.04 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其水溶液显弱酸性,俗称石炭酸 | |
| B. | 其浓溶液对皮肤有强烈的腐蚀性,如果不慎沾在皮肤上,应立即用酒精擦洗 | |
| C. | 其在水中的溶解度随温度的升高而增大,超过65℃可以与水以任意比互溶 | |
| D. | 苯酚溶液不能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素原子的最外层电子数等于元素的最高化合价 | |
| B. | 多电子原子中,在离核较近的区域内运动的电子能量较低 | |
| C. | 若M+和R2-的核外电子层结构相同,则原子序数:R>M | |
| D. | 元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com