
【题目】某有机物的结构简式如图所示,下列说法中不正确的是( )
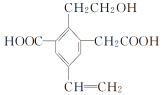
A.1mol该有机物和过量的金属钠反应最多可以生成1.5molH2
B.该物质最多消耗Na、NaOH、NaHCO3的物质的量之比为3∶2∶2
C.可以用酸性KMnO4溶液检验其中的碳碳双键
D.该物质能够在催化剂作用下被氧化为含有—CHO的有机物
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是
2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是

A. ①中溶液橙色加深,③中溶液变黄
B. ②中Cr2O72-被C2H5OH还原
C. 对比②和④可知K2Cr2O7酸性溶液氧化性强
D. 若向④中加入70%H2SO4溶液至过量,溶液变为橙色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,3—环己二酮(![]() )常用作医药中间体,用于有机合成。1,3—环己二酮的一种合成路线如图所示。
)常用作医药中间体,用于有机合成。1,3—环己二酮的一种合成路线如图所示。
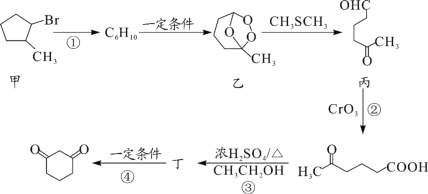
回答下列问题:
(1)甲的分子式为___。
(2)丙中含有官能团的名称是___。
(3)反应①所需的试剂和条件是___;②的反应类型是___。
(4)丁的结构简式为___。
(5)写出丙与新制氢氧化铜悬浊液反应的化学方程式___。
(6)符合下列条件的乙的同分异构体共有___种。
①能发生银镜反应
②能与NaHCO3溶液反应
其中核磁共振氢谱峰面积之比为1∶1∶2∶6的一种同分异构体的结构简式为___(任写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H3BO3是一元酸,室温时,用1.0mol·L-1的NaOH溶液滴定25.00mL H3BO3溶液的曲线如图所示:
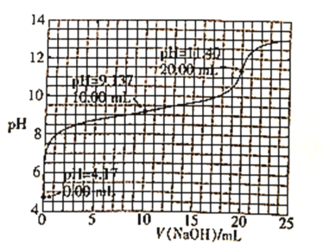
下列说法正确的是( )
A.可用酚酞作滴定指示剂
B.起始时H3BO3的浓度为0.8mol·L-1
C.H3BO3的电离常数数量级为10-5
D.滴定至pH=12时,溶液中:c(OH-)<c(H3BO3)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬及其化合物在材料、颜料及超导等方面用途非常广泛。回答下列问题:
(1)基态Cr原子的价电子排布式为__;Cr成为阳离子时首先失去__轨道的电子。
(2)铬与钾均位于第四周期,铬的熔点和沸点均比钾的高,这是因为__。
(3)甘氨酸铬(结构如图)是一种配合物,其配位原子是__。
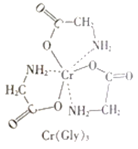
(4)反应:6KSCN+13K2Cr2O7+55H2SO4=13Cr2(SO4)3+6SO2↑+6CO2↑+16K2SO4+55H2O
①KSCN的四种组成元素中第一电离能最大的是__(填元素符号);KSCN中阴离子的空间构型为___形,中心原子的杂化方式是__。
②分子中的大![]() 键可用符号
键可用符号![]() 表示,其中m代表参与形成大
表示,其中m代表参与形成大![]() 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大![]() 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大![]() 键可表示为
键可表示为![]() ),则NO2的大
),则NO2的大![]() 键可表示为__。
键可表示为__。
(5)立方CrO2晶体的结构如图所示,晶胞参数为apm。
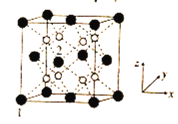
①设NA为阿伏加德罗常数的值,则CrO2的密度为__(列出计算式)g·cm-3。
②1、2号原子的坐标依次为(0,0,0)、(![]() ,0,
,0,![]() ),则原子坐标为(
),则原子坐标为(![]() ,
,![]() ,
,![]() )和(
)和(![]() ,
,![]() ,
,![]() )间的距离为__pm。
)间的距离为__pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是( )
A.NaCl![]() Cl2(g)
Cl2(g)![]() FeCl2(s)
FeCl2(s)
B.N2(g)![]() NH3(g)
NH3(g)![]() NaHCO3(s)
NaHCO3(s)
C.AgNO3(aq)![]() Ag(NH3)2OH
Ag(NH3)2OH![]() Ag(s)
Ag(s)
D.S(s)![]() SO3(g)
SO3(g)![]() H2SO4(aq)
H2SO4(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烃A的产量能衡量一个国家石油化工发展水平,F的碳原子数为D的两倍,以A为原料合成F,其合成路线如图所示:
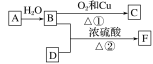
(1)写出决定B、D性质的重要原子团的名称:
B________、D________。
(2)A的结构式为____________。
(3)写出下列反应的化学方程式并注明反应类型:
①______________________________________________,反应类型:__________;
②______________________________________________,反应类型:__________。
(4)实验室怎样区分B和D?_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锑(Sb)是第VA族元素,其单质主要用于制造合金、半导体。三氧化二锑俗称锑白,是白色粉末,不溶于水,是一种两性氧化物,主要用于白色颜料、油漆和塑料、石油化工等。某工厂用羽毛矿(主要成分为Pb4FeSb6S14)制取锑白的工艺流程如图所示:

(1)Pb4FeSb6S14中的锑元素只显一种化合价,则其化合价是______。X是一种固体单质,其成分是___(填化学式)。
(2)氯化浸出中,除铅与X外,被氧化的元素反应后均显高价,写出相应的化学方程式:______________。操作1为加水稀释,写出生成SbOCl的离子方程式:___________。
(3)试剂1通常选用氨水而不是NaOH溶液,最可能的原因是_______。操作2的内容是_________、干燥。
(4)在强碱性条件下电解Na3SbS3溶液(原理如图)可得到单质锑。

写出阴极的电极反应式:_______,B电极应接电源的______极,当有2 mol Sb生成时,通过阳离子交换膜的离子数为_________(设NA为阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积不变的密闭容器中发生反应N2(g)+3H2(g)![]() 2NH3(g),下列叙述表示该反应处于化学平衡状态的是( )
2NH3(g),下列叙述表示该反应处于化学平衡状态的是( )
A.N2、H2、NH3的浓度之比为1∶3∶2
B.混合气体的密度不随时间变化
C.当有1molN≡N键断裂时,有6molN—H键断裂
D.单位时间内生成2amolNH3,同时消耗amolN2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com