
| A. | 1.0 mol | B. | 1.5 mol | C. | 2.0 mol | D. | 2.5 mol |
分析 根据混合气体的物质的量可得被还原的硝酸的物质的量,根据生成硝酸铜的物质的量可知表现酸性的硝酸的物质的量,以此计算反应消耗的硝酸的物质的量.
解答 解:铜和硝酸反应,随着浓度的减少,硝酸的还原产物的价态越低,铜和浓硝酸反应生成NO2,而与稀硝酸反应时则生成NO,故生成的气体有NO2和NO,
则n(NO2)+n(NO)=$\frac{22.4L}{22.4L/mol}$=1mol,即被还原的硝酸的物质的量为1mol,
n(Cu)=$\frac{32}{64g/mol}$=0.5mol,则生成n(Cu(NO3)2)=0.5mol,
可知表现酸性的硝酸的物质的量为0.5mol×2=1mol,
则参加反应的硝酸的物质的量为1mol+1mol=2mol.
故选C.
点评 本题以硝酸为载体考查了物质的量的计算,根据硝酸铜的化学式及N原子守恒计算消耗硝酸的物质的量,题目难度不大.


科目:高中化学 来源: 题型:解答题
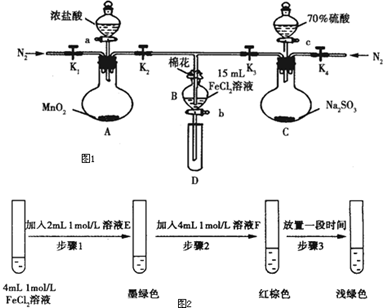
| 过程Ⅳ:B溶液中含有的离子 | 过程Ⅵ:B溶液中含有的离子 | |
| 甲 | 有Fe3+,无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+、又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+、无Fe2+ | 有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | |||||||||||||||||
| W | T | M | F | ||||||||||||||
| B | D | Z | J | L | H | V | |||||||||||
| C | E | G | Q | ||||||||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
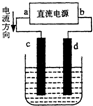
| A. | a为负极、b为正极 | B. | c电极上发生还原反应 | ||
| C. | 电解过程中,d电极质量增加 | D. | 电解过程中,氯离子浓度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表共18列,从左到右的第十七列为卤族元素 | |
| B. | 同一周期元素的原子,半径越小越容易失去电子 | |
| C. | 副族元素全部是金属元素 | |
| D. | 在过渡元素中,人们可以寻找到各种优良的催化剂和高温、耐腐蚀的合金材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.8a g | B. | 0.0745b g | C. | 0.0376c g | D. | 无法计算 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com