
 黄血盐(亚铁氰化钾,K4[Fe(CN)6])易溶于水,广泛用作食盐添加剂(抗结剂),食盐中黄血盐的最大使用量为10mg•kg-1.黄血盐经长时间火炒,超过400℃时会分解生成剧毒的氰化钾.回答下列问题:
黄血盐(亚铁氰化钾,K4[Fe(CN)6])易溶于水,广泛用作食盐添加剂(抗结剂),食盐中黄血盐的最大使用量为10mg•kg-1.黄血盐经长时间火炒,超过400℃时会分解生成剧毒的氰化钾.回答下列问题:分析 (1)铁是26号元素,其原子核外有26个电子,铁原子失去2个电子变成Fe2+,根据构造原理书写Fe2+核外电子排布式,根据电子排布式可知未成对电子数,提供空轨道的原子和提供孤电子对的原子之间易形成配位键;
(2)根据价层电子对互斥理论确定其杂化方式;1个CN-中含有2个π键;
(3)黄血盐溶液与稀硫酸加热时发生非氧化还原反应,说明元素化合价不变,生成硫酸盐和一种与CN-是等电子体的气态化合物,根据元素守恒知该气态化合物是CO,根据反应物和生成物、反应条件写出反应方程式;
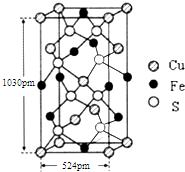
(4)根据均摊法可知,铁原子的数目为4×$\frac{1}{4}$+6×$\frac{1}{2}$=4,铜原子数为8×$\frac{1}{8}$$+4×\frac{1}{2}$+1=4,硫原子数为8,据此判断化学式,根据ρ=$\frac{m}{V}$计算.
解答 解:(1)铁是26号元素,其原子核外有26个电子,铁原子失去最外层2个电子变成Fe2+,根据构造原理知,其基态离子核外电子排布式为1s22s22p63s23p63d6 或[Ar]3d6 ,未成对电子数为1,亚铁离子含有空轨道,N原子含有孤电子对,所以能形成配位键,
故答案为:1s22s22p63s23p63d6 或[Ar]3d6 ; 1;配位键;
(2)CN-中碳原子含有2个σ键且不含孤电子对,所以碳原子的杂化方式为 sp;1个CN-中含有2个π键,所以1molCN-中含有π键的数目为2NA个,
故答案为:sp;2NA;
(3)黄血盐溶液与稀硫酸加热时发生非氧化还原反应,说明元素化合价不变,生成硫酸盐和一种与CN-是等电子体的气态化合物,根据元素守恒知该气态化合物是CO,键线式为C≡O,铁元素存在于硫酸亚铁中,钾元素存在于硫酸钾中,所以该反应方程式为:K4Fe(CN)6+6H2SO4+6H2O $\frac{\underline{\;\;△\;\;}}{\;}$ 2K2SO4+FeSO4+3(NH4)2 SO4+6CO↑,
故答案为:C≡O;K4Fe(CN)6+6H2SO4+6H2O $\frac{\underline{\;\;△\;\;}}{\;}$ 2K2SO4+FeSO4+3(NH4)2 SO4+6CO↑;
(4)根据均摊法可知,铁原子的数目为4×$\frac{1}{4}$+6×$\frac{1}{2}$=4,铜原子数为8×$\frac{1}{8}$$+4×\frac{1}{2}$+1=4,硫原子数为8,所以化学式为FeCuS2,根据ρ=$\frac{m}{V}$=$\frac{\frac{4×(64+56+32×2)}{{N}_{A}}}{1030pm×524pm×524pm}$=$\frac{4×184g}{6.02×1{0}^{23}×1030×1{0}^{-10}×(524×1{0}^{-10})^{2}cm}$,
故答案为:FeCuS2;$\frac{4×184g}{6.02×1{0}^{23}×1030×1{0}^{-10}×(524×1{0}^{-10})^{2}cm}$.
点评 本题考查较综合,涉及电子排布式的书写、杂化方式的判断、配位数的计算等知识点,难点是配位数的计算,同时考查学生空间想象能力,难度较大.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸钠溶液和醋酸铅溶液均能使蛋白质变性 | |
| B. | 油脂是高级脂肪酸的甘油酯,均不能发生氢化反应 | |
| C. | H2N-CH2-COOH既能与盐酸反应、又能与氢氧化钠溶液反应 | |
| D. | 合成橡胶 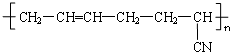 的单体之一是CH3-C≡C-CH3 的单体之一是CH3-C≡C-CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 步骤 | 操 作 | 现 象 |
| ① | 用pH试纸检验 | 溶液的pH大于7 |
| ② | 向溶液中滴加氯水,再加入CCl4振荡,静置 | CCl4层呈橙色 |
| ③ | 向②所得溶液中加入Ba(NO3)2溶液和稀HNO3 | 有白色沉淀产生 |
| ④ | 将③过滤,向滤液中加入AgNO3溶液和稀HNO3 | 有白色沉淀产生 |
| A. | 可能含有的离子是①③⑥ | B. | 肯定没有的离子只有② | ||
| C. | 不能确定的离子只有⑤ | D. | 肯定含有的离子是①③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 洗净的滴定管和容量瓶可以放进烘箱中烘干 | |
| B. | 用10mL量筒量取10.00mLNaCl溶液 | |
| C. | 酸式滴定管装标准溶液前,必须先用该溶液润洗2~3次 | |
| D. | 用容量瓶配溶液时,若加水超过刻度线,立即用滴管吸出多余液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=2的溶液中:NH4+、Na+、Cl-、Cu2+ | |
| B. | 加入KSCN显红色的溶液:K+、NH4+、Cl-、CO32- | |
| C. | 无色溶液中:K+、CH3COO-、HCO3-、MnO4- | |
| D. | 含有大量NaClO的水溶液中:Fe2+、Cl-、Ca2+、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硫化钠是一种重要的化工原料.工业上用硫酸钠与碳反应得到硫化钠.反应方程式如下:
硫化钠是一种重要的化工原料.工业上用硫酸钠与碳反应得到硫化钠.反应方程式如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com