
| A. | 19gH3O+共用的电子对数为2NA | |
| B. | 34gD2O2所含电子数为18NA | |
| C. | 1mol羟基(-16OH) 所含中子数为8NA | |
| D. | D16OD、T16OH共10g,所含中子数各为0.25NA |
分析 A、求出H3O+的物质的量,然后根据1molH3O+含3mol共用电子对来分析;
B、求出D2O2的物质的量,然后根据1molD2O2中含18mol电子来分析;
C、1mol羟基(-16OH)含8mol中子;
D、D16OD、T16OH的摩尔质量均为20g/mol,求出混合物的物质的量,然后根据1molD16OD、T16OH中均含10mol中子来分析.
解答 解:A、19gH3O+的物质的量n=$\frac{19g}{19g/mol}$=1mol,而1molH3O+含3mol共用电子对,即3NA个,故A错误;
B、34gD2O2的物质的量n=$\frac{34g}{36g/mol}$=$\frac{17}{18}$mol,而1molD2O2中含18mol电子,故$\frac{17}{18}$molD2O2中含17NA个电子,故B错误;
C、1mol羟基(-16OH)含8mol中子,即8NA个,故C正确;
D、D16OD、T16OH的摩尔质量均为20g/mol,故10g混合物的物质的量为0.5mol,而1molD16OD、T16OH中均含10mol中子,故0.5mol混合物中含5mol中子,即5NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
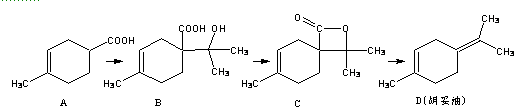
| A. | 1molA可与2molNaOH完全反应 | |
| B. | 如果条件合适,B可能发生加聚反应,也可能发生缩聚反应 | |
| C. | 有机物C的所有同分异构体中不可有芳香族化合物存在 | |
| D. | D 与Br2的CCl4溶液反应,最多有4种生成物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L乙醇完全燃烧所生成的气态产物的分子数为NA | |
| B. | 1 mol甲基(-CH3)所含的电子总数为9NA | |
| C. | 0.5摩尔硅中含有的化学键数目为NA | |
| D. | 1 mo CH3+所含的电子总数为8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验. 序号 | 碳酸钙 | C(HCl)/ mol•L-1 | 溶液温度/℃ | 碳酸钙消失 时间/s | |
| 反应前 | 反应后 | ||||
| 1 | 块状 | 0.5 | 20 | 39 | 400 |
| 2 | 粉末 | 0.5 | 20 | 40 | 60 |
| 3 | 块状 | 0.6 | 20 | 41 | 280 |
| 4 | 粉末 | 0.8 | 20 | 40 | 30 |
| 5 | 块状 | 1.0 | 20 | 40 | 120 |
| 6 | 块状 | 1.0 | 30 | 50 | 40 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锂与水反应不如钠与水反应剧烈 | |
| B. | 还原性:K>Na>Li,故K可以从NaCl溶液中置换出金属钠 | |
| C. | 熔沸点:Li>Na>K | |
| D. | 原子半径:Li<Na<K |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含HS-溶液中:K+、Cu2+ NO3-、SO42- | |
| B. | 某无色透明的溶液:Mg2+、ClO-、SiO32- Na+ | |
| C. | 加入(NH4)2CO3后加热,有气体产生的溶液:Na+ K+、NO3- HCO3- | |
| D. | pH=0:Na+ Ca2+ Fe3+ NO3- Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
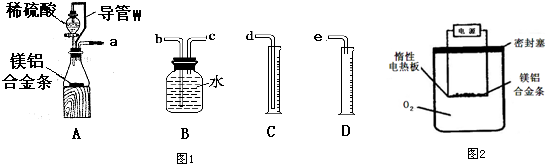
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.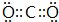 .
.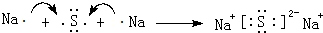
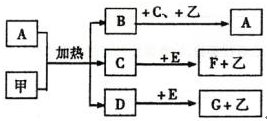
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com