
| A������pH=3��HCl��pH=11��NH3?H2O��Һ�������϶��� |
| B������Һ�����Ӽ�һ�����㣺c��NH4+��+c��H+��=c��OH-��+c��Cl-�� |
| C����������NH3?H2O����Һ������Ũ�ȿ���Ϊ��c��NH4+����c��Cl-����c��OH-����c��H+�� |
| D������Һ�����ɵ����ʵ���Ũ�ȡ��������HCl��Һ��NH3?H2O��Һ��϶��� |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A����״���£��ܶ�Ϊd g/L��ij���崿����һ�����ӵ�����Ϊ
| ||
| B�����³�ѹ�£�17g����-14CH3��������������Ϊ9NA | ||
| C����0.1NA��������������ˮ���1����Һ����Һ��c��Cl-��=0.1mol/L | ||
| D������������NaOH��Ӧ����ÿ����6.72L��H2������Һ��AlO2-����Ŀ�ͻ�����0.2NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����������Һ�м��������ˮ��Al3++3OH-�TAl��OH��3�� |
| B����������Һ�еμ�Ba��OH��2��Һ��Al3+�պó�����ȫ��2Al3++3SO42-+3Ba2++6OH-�T3BaSO4��+2Al��OH��3�� |
| C��NH4HCO3���ڹ�����NaOH��Һ�У�HCO3-+OH-�TCO32-+H2O |
| D��ϡ�����м������ۣ�2Fe+6H+�T2Fe3++3H2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�����ǹ��ۻ����� |
| B�������н�ǿ��ԭ�� |
| C����ͬλ��ԭ�ӹ��ɵ�ͬ���칹�� |
| D�����İ뾶H-С��Li+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 1 |
| 2 |
| 1 |
| 2 |
| 25 |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
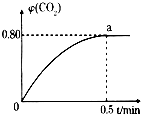 ���û�ѧ��Ӧԭ���о�̼�Ļ����������Ҫ���壮
���û�ѧ��Ӧԭ���о�̼�Ļ����������Ҫ���壮�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���� |
| �� |
| 250��350�� |
| ͭ�� |
| �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��pH=2�������pH=12��Ba��OH��2��Һ��Ϻ�pH=7 |
| B��0.1 mol?L-1��KHA��Һ����pH=10��c��HA-����c��OH-����c��H+����c��A2-�� |
| C��pH=6�Ĵ���������ƻ����Һ�У�c��Na+����c��CH3COO-�� |
| D��pH��ȵ�CH3COONa��Na2CO3��NaHCO3������Һ��c��NaHCO3����c��CH3COONa����c��Na2CO3�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com