
Zn+2MnO2+2![]()
![]() Zn2++Mn2O3+2NH3+2H2O
Zn2++Mn2O3+2NH3+2H2O
(1)写出该干电池放电时的电极反应式:
正极:_________________,负极:___________________。
(2)正极反应中,前后经历了下列两个反应:
2![]() +2e-
+2e-![]() 2NH3+H2↑,2MnO2+H2
2NH3+H2↑,2MnO2+H2![]() Mn2O3+H2O
Mn2O3+H2O
如果正极反应没有MnO2的参与,干电池将难以持续稳定的工作。试说明理由:____________。
(3)在通电10 min的时间内参加反应MnO2的质量约为多少?外电阻消耗的电能是多少?
___________________________________________________________
(4)许多国家对废旧电池进行回收,从保护环境和节约材料的方面解释为什么要回收废旧电池。
___________________________________________________________
 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:
Zn+2MnO2+2![]() ====Zn2++Mn2O3+2NH3+H2O
====Zn2++Mn2O3+2NH3+H2O
(1)试写出干电池放电时的正、负电极反应式:
正极:___________,负极:___________;
干电池用久了就会变软,其原因是_________________________________。
(2)正极反应中,前后经历了下列两个反应:
2![]() +2e-====2NH3+H2↑,2MnO2+H2====Mn2O3+H2O
+2e-====2NH3+H2↑,2MnO2+H2====Mn2O3+H2O
如果正极反应没有MnO2的参与,干电池将难于持续稳定工作。试说明理由:_________
_____________________________。
(3)在通电10 min的时间内参加反应的MnO2质量约为多少?外电阻消耗的电能是多少?
(4)许多国家对废旧电池进行回收,从保护环境和节约能源角度解释为什么要回收废旧电池。
查看答案和解析>>
科目:高中化学 来源: 题型:
锌—锰干电池是普遍使用的化学电源,其中含有MnO2、NH4Cl、ZnCl2等的糊状物。以锌筒为负极材料,石墨为正极材料。一节干电池电动势和内电阻分别为E=1.5 V,r=0.25 Ω,它对外供电时效率η=75%。干电池的工作原理是:
Zn+2MnO2+2NH![]() ===Zn2++Mn2O3+2NH3+H2O
===Zn2++Mn2O3+2NH3+H2O
(1)试写出干电池放电时的正、负电极反应式:正极:___________负极:___________
干电池用久了就会变软,其原因是____________________________________________。
(2)正极反应中,前后经历了下列两个反应:
2NH![]() +2e-===2NH3+H2
+2e-===2NH3+H2
2MnO2+H2===Mn2O3+H2O
如果正极反应没有MnO2的参与,干电池将难以持续稳定工作。试说明理由。
(3)在通电10 min的时间内参加反应的MnO2质量约为多少?外电阻消耗的电能是多少?
(4)许多国家对废旧电池进行回收,从保护环境和节约能源解释为什么要回收废旧电池。
查看答案和解析>>
科目:高中化学 来源: 题型:
锌—锰干电池是普遍使用的化学电源,其中含有MnO2、NH4Cl、ZnCl2等的糊状物。以锌筒为负极材料,石墨为正极材料。一节干电池电动势和内电阻分别为E=1.5 V,r=0.25 Ω,它对外供电时效率η=75%。干电池的工作原理是:
Zn+2MnO2+2NH![]() ===Zn2++Mn2O3+2NH3+H2O
===Zn2++Mn2O3+2NH3+H2O
(1)试写出干电池放电时的正、负电极反应式:正极:___________负极:___________
干电池用久了就会变软,其原因是____________________________________________。
(2)正极反应中,前后经历了下列两个反应:
2NH![]() +2e-===2NH3+H2
+2e-===2NH3+H2
2MnO2+H2===Mn2O3+H2O
如果正极反应没有MnO2的参与,干电池将难以持续稳定工作。试说明理由。
(3)在通电10 min的时间内参加反应的MnO2质量约为多少?外电阻消耗的电能是多少?
(4)许多国家对废旧电池进行回收,从保护环境和节约能源解释为什么要回收废旧电池。
查看答案和解析>>
科目:高中化学 来源: 题型:
锌-锰干电池是普遍使用的化学电源,电解质溶液采用MnO2、NH4Cl、ZnCl2等的糊状物,以锌筒为负极材料,以石墨为正极材料。一节干电池的电动势和内阻分别为:E=1.5V、r=0.25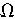 ,对外供电时的效率为?浊=75%。干电池的工作原理是:
,对外供电时的效率为?浊=75%。干电池的工作原理是: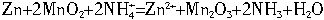
(1)正极反应中,前后经历了以下两个反应,有水生成: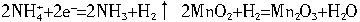
如果正极反应没有MnO2参与,干电池将难于持续稳定工作,理由是________。
(2)在通电10min的时间内,参加反应的MnO2的质量为多少?外电阻消耗的电能是多少?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com