
| A. | 石油破裂的主要目的是得到乙烯 | |
| B. | 有机物结构的分析方法有核磁共振法、红外光谱法、质谱法和紫外光谱法等 | |
| C. | 李比希提出基团的概念,并首次使用无机盐合成尿素,突破了有机物与无机物的界限 | |
| D. | 糖类、油脂、蛋白质是人类重要营养物质 |
分析 A.裂解的目的是为了获得乙烯、丙烯、丁二烯、丁烯、乙炔等;
B.红外光谱仪用于测定有机物的官能团;核磁共振氢谱用于测定有机物分子中氢原子的种类和数目;质谱法用于测定有机物的相对分子质量;紫外光谱鉴别一个有机物是否含有共轭体系或芳香结构;
C.1828年德国化学家维勒,将一种无机物NH4CNO的水溶液加热得到了有机物尿素;
D.糖类、油脂和蛋白质都是基本营养物质.
解答 解:A.裂解的目的是为了获得乙烯、丙烯、丁二烯、丁烯、乙炔等,主要目的是得到乙烯,故A正确;
B.红外光谱仪用于测定有机物的官能团;核磁共振氢谱用于测定有机物分子中氢原子的种类和数目;质谱法用于测定有机物的相对分子质量,紫外光谱鉴别一个有机物是否含有共轭体系或芳香结构,所以核磁共振谱、红外光谱、紫外光谱和质谱法的综合运用,可用于分析有机物的结构,故B正确;
C.维勒用无机物NH4CNO合成了有机物尿素,突破了无机物与有机物的界限,故C错误;
D.糖类、油脂和蛋白质都是人类基本营养物质,故D正确.
故选C.
点评 本题考查了石油加工、实验方法、化学史等知识点,明确实验原理是解本题关键,注意B中这些方法的作用及区别,为易错点.


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案科目:高中化学 来源: 题型:解答题
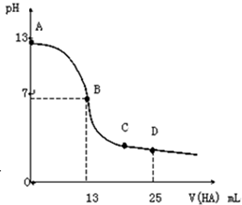 常温下,向25mL0.1mol•L-1MOH溶液中逐滴加入0.2mol•L-1HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题:
常温下,向25mL0.1mol•L-1MOH溶液中逐滴加入0.2mol•L-1HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | H2O | B. | CuO | C. | Cu(OH)2 | D. | CuCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
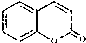 )是一种用途广泛的香料,其合成路线如图:
)是一种用途广泛的香料,其合成路线如图: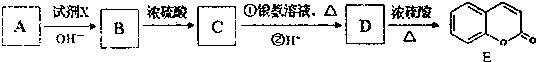
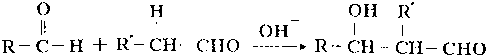
 ;
;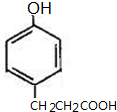 、
、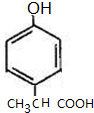 (写出一种即可).
(写出一种即可).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 | LA | 0 | ||||||
| 周期 | ||||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ||||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ||||
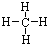

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl-、ClO-、Cl2三种微粒只具有氧化性,没有还原性 | |
| B. | Cl2具有强氧化性,可以把水中的氧置换出来 | |
| C. | 因为SO2具有还原性,所以与氯水可以反应生成H2SO4和HCl | |
| D. | Cl2转变为HClO时一定需要加入氧化剂才能实现 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com