
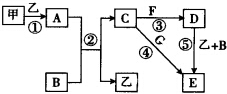
 下列框图中的物质均为中学化学中常见物质,其中甲、乙为单质,其余均为化合物.B为常见液态化合物,A为淡黄色固体,F、G所含元素相同且均为氯化物,G遇KSCN溶液显红色.
下列框图中的物质均为中学化学中常见物质,其中甲、乙为单质,其余均为化合物.B为常见液态化合物,A为淡黄色固体,F、G所含元素相同且均为氯化物,G遇KSCN溶液显红色.分析 甲、乙为单质,二者反应生成A为淡黄色固体,则A为Na2O2,甲、乙分别为Na、氧气中的一种;B为常见液态化合物,与A反应生成C与乙,可推知B为H2O、乙为氧气、C为NaOH,则甲为Na;F、G所含元素相同且均为氯化物,G遇KSCN溶液显红色,则G为FeCl3,F为FeCl2,结合转化关系可知,E为Fe(OH)3,D为Fe(OH)2,以此解答该题.
解答 解:甲、乙为单质,二者反应生成A为淡黄色固体,则A为Na2O2,甲、乙分别为Na、氧气中的一种;B为常见液态化合物,与A反应生成C与乙,可推知B为H2O、乙为氧气、C为NaOH,则甲为Na;F、G所含元素相同且均为氯化物,G遇KSCN溶液显红色,则G为FeCl3,F为FeCl2,结合转化关系可知,E为Fe(OH)3,D为Fe(OH)2,
(1)由上述分析可知,A为Na2O2,
故答案为:Na2O2;
(2)反应①~⑤中,①②⑤属于氧化还原反应,③④属于非氧化还原反应,故答案为:①②⑤;
(3)反应⑤的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
甲与B反应的离子方程式为:2Na+2H2O=2Na++2OH-+H2↑,
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;2Na+2H2O=2Na++2OH-+H2↑;
(4)在空气中将NaOH溶液滴入FeCl2溶液中,先生成氢氧化亚铁沉淀,再被氧化生成氢氧化铁,观察到的现象是:先生成白色沉淀,然后迅速变为灰绿色,最终变为红褐色,
故答案为:先生成白色沉淀,然后迅速变为灰绿色,最终变为红褐色.
点评 本题考查无机物推断,涉及Na、Fe元素化合物的性质及转化,物质的颜色是推断突破口,再结合转化关系推断,需要学生熟练掌握物质的性质,难度中等.


科目:高中化学 来源: 题型:选择题
| R | ||||
| T | Q | W |
| A. | 工业电解熔融的 TW3制得单质T | |
| B. | 元素R和元素Q的最高正化合价相同 | |
| C. | 单核阴离子半径的大小顺序为r(Q)>r(W)>r(R) | |
| D. | 阴离子的还原性:Q<W |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除③外 | B. | 除③⑤外 | C. | 除③④外 | D. | 除⑥外 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
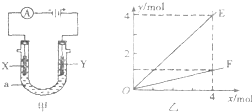 电解原理在化学工业中有着广泛的应用.图甲表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.则下列说法不正确的是( )
电解原理在化学工业中有着广泛的应用.图甲表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.则下列说法不正确的是( )| A. | 若此装置用于电解精炼铜,则X为纯铜、Y为粗铜,电解的溶液a可以是硫酸铜或氯化铜溶液 | |
| B. | 按图甲装置用惰性电极电解AgN03溶液,若图乙横坐标x表示流入电极的电子的物质的量,则E可表示反应生成硝酸的物质的量,F表示电解生成气体的物质的量 | |
| C. | 按图甲装置用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,加入0.5mol的碳酸铜刚好恢复到通电前的浓度和pH,则电解过程中转移的电子为2.0 mol | |
| D. | 若X、Y为铂电极.a溶液为500 mL KCl和KNO3的混合液,经过一段时间后,两极均得到标准状况下11.2 L气体,则原混合液中KCl的物质的量浓度至少为2.0 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
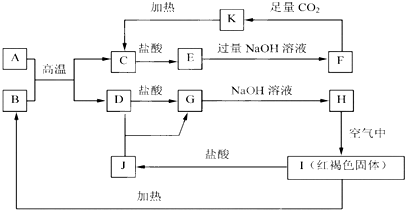
 短周期元素X、Y、Z、W在周期表中的位置关系如右图所示,已知在同周期元素的常见简单离子中,W的简单离子半径最小,X、Y、Z、W的单质及其化合物在日常生活中用途极其广泛.
短周期元素X、Y、Z、W在周期表中的位置关系如右图所示,已知在同周期元素的常见简单离子中,W的简单离子半径最小,X、Y、Z、W的单质及其化合物在日常生活中用途极其广泛.| X | Y | Z | |
| W |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgCl是还原产物 | |
| B. | 负极的电极反应为:Ag+Cl--e-═AgCl | |
| C. | Na+不断向“水”电池的正极移动 | |
| D. | 每生成1mol Na2Mn5O10转移2mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
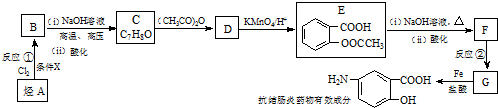
 $\stackrel{(CH_{3}CO)_{2}O}{→}$
$\stackrel{(CH_{3}CO)_{2}O}{→}$ (b)
(b)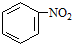 $→_{盐酸}^{Fe}$
$→_{盐酸}^{Fe}$
 ;
; ;
; ;
; )易被氧化,苯环上连有烷基时再引入一个取代基,常取代
)易被氧化,苯环上连有烷基时再引入一个取代基,常取代 ) 合成路线中两种中间产物的结构简式(部分反应条
) 合成路线中两种中间产物的结构简式(部分反应条 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
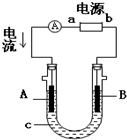 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com