
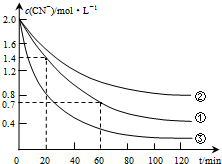
 生产中可用双氧水氧化法处理电镀含氰废水,某化学兴趣小组模拟该法探究有关因素对破氰反应速率的影响(注:破氰反应是指氧化剂将CN-氧化的反应).
生产中可用双氧水氧化法处理电镀含氰废水,某化学兴趣小组模拟该法探究有关因素对破氰反应速率的影响(注:破氰反应是指氧化剂将CN-氧化的反应).| 实验 序号 | 实验目的 | 初始pH | 废水样品体积/mL | CuSO4溶液的体积/mL | 双氧水溶液的体积/mL | 蒸馏水的体积/mL |
| ① | 为以下实验操作参考 | 7 | 60 | 10 | 10 | 20 |
| ② | 废水的初始pH对破氰反应速率的影响 | 12 | 60 | 10 | 10 | 20 |
| ③ | 双氧水的浓度对破氰反应速率的影响 | 7 | 60 | 10 | 20 | 10 |
| 实验步骤(不要写出具体操作过程) | 预期实验现象和结论 |
分析 (1)实验的目的是调节含氰废水样品不同的初始pH和一定浓度双氧水溶液的用量,应分别检测废水的初始pH对破氯反应速率的影响和双氧水的浓度对破氰反应速率的影响;
(2)根据v=$\frac{△c}{△t}$,进行计算求解;
(3)pH越大,[Fe(CN)6]3-越稳定,越难被氧化,破氰反应速率减小;根据条件结合氧化还原反应的知识解答;
(4)分别取温度相同、体积、浓度相同的含氰废水的试样两等份,滴加过氧化氢,一份中加入少量的无水硫酸铜粉末,另一份不加,用用离子色谱仪测定废水中的CN一浓度来做对比实验.
解答 解:(1)影响该反应的因素有pH以及双氧水的浓度,实验目的为废水的初始pH对破氰反应速率的影响和双氧水的浓度对破氰反应速率的影响,其它量应不变,而且总体积不变,蒸馏水的体积为10mL,所以双氧水的体积为20mL,
故答案为:双氧水的浓度对破氰反应速率的影响;10;20;
(2)根据v=$\frac{△c}{△t}$=$\frac{1.4-0.7}{60-20}$=0.0175mol•L-1•min-1,故答案为:0.0175;
(3)pH越大,[Fe(CN)6]3-越稳定,越难被氧化,所以破氰反应速率减小;因为氰废水中的CN一最终被双氧水氧化为HC03,其中的碳由+2价变成+4价,1mol转移2mol的电子,而过氧化氢1mol也转移2mol的电子,所以CN一和H2O2的物质的量之比为1:1,所以反应的离子方程式为:CN-+H2O2+H2O═NH3↑+HCO3-,
故答案为:初始pH增大,催化剂Cu2+会形成Cu(OH)2沉淀,影响了Cu2+的催化作用(或初始pH增大,[Fe(CN)6]3-较中性和酸性条件下更稳定,难以氧化);CN-+H2O2+H2O═NH3↑+HCO3-;
(4)分别取温度相同、体积、浓度相同的含氰废水的试样两等份,滴加过氧化氢,一份中加入少量的无水硫酸铜粉末,另一份不加,用用离子色谱仪测定废水中的CN一浓度,如果在相同时间内,若甲试管中的CN-浓度小于乙试管中的CN-浓度,则Cu2+对双氧水破氰反应起催化作用,反之则不起催化作用,故答案为:
| 实验方案(不要求写出具体操作过程) | 预期实验现象和结论 |
| 分别取等体积、等浓度的含氰废水于甲、乙两支试管中,再分别加入等体积、等浓度的双氧水溶液,只向甲试管中加入少量的无水硫酸铜粉末,用离子色谱仪测定相同反应时间内两支试管中的CN-浓度 | 相同时间内,若甲试管中的CN-浓度小于乙试管中的CN-浓度,则Cu2+对双氧水破氰反应起催化作用;若两试管中的CN-浓度相同,则Cu2+对双氧水破氰反应不起催化作用 |
点评 本题考查外界条件的变化对化学反应速率的影响,为高频考点,侧重于学生的分析、计算能力的考查,学生要清楚在研究一个变量引起速率变化的时候,其它的量应该相同,另还要学会以用对比实验,来得出结论,有一定的难度.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 若某温度下,反应后$\frac{c(C{l}^{-})}{c(Cl{O}^{-})}$=11,则溶液中$\frac{c(Cl{O}^{-})}{c(Cl{O}_{3}^{-})}$=$\frac{1}{5}$ | |
| B. | 参加反应的被还原的氯气为$\frac{1}{4}$amol | |
| C. | 改变温度,反应中转移电子的物质的量ne的范围:$\frac{1}{2}$amol≤ne≤$\frac{5}{6}$amol | |
| D. | 改变温度,产物中KClO3的最大理论产量为$\frac{5}{6}$amol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO、NO、NaH、N2 | B. | SO2、NO2+、N3-、CNO- | ||
| C. | CO32-、NO3-、BeCl2 | D. | SiF4、SiO44-、SO42-、PO43- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第三电子层上有4个电子 | B. | 最高正价为+2 | ||
| C. | 最高正价为+4 | D. | 第二电子层没有未成对电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g)?PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的部分数据如图.下列说法正确的是( )
温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g)?PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的部分数据如图.下列说法正确的是( )| A. | 反应在前50 s 的平均速率v(PCl3)=0.0032 mol•L-1•s-1 | |
| B. | 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol•L-1,则反应的△H<0 | |
| C. | 相同温度下,起始时向容器中充入2.0 mol PCl3和2.0mol Cl2,达到平衡时,PCl3 的转化率小于80% | |
| D. | 相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3 和0.20 mol Cl2,反应达到平衡前v(正)>v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题


| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com